Что такое электролитическая диссоциация
Давно известно, что некоторые растворы проводят электрический ток (такие растворы получили название электролитов), а некоторые - не проводят (неэлектролиты).
Кроме электропроводности электролиты и неэлектролиты имеют много других отличий. При одинаковой молярной концентрации электролиты (по сравнению с неэлектролитами) обладают:
- более высокой температурой кипения;
- более низкой температурой замерзания;
- более высоким осмотическим давлением;
- более низким давлением пара растворителя.
Такое большое различие в свойствах растворов ученые объясняют тем фактом, что в электролитах при растворении образуется гораздо большее кол-во частиц, которые еще и обладают зарядом, хотя, в общем, раствор электролита нейтрален.
Впервые теорию электролитической диссоциации (разделения) сформулировал в 1887 г. шведский ученый С. Аррениус, ее основные положения заключались в следующем:
- электролиты, растворяясь в воде, диссоциируют (распадаются) на положительно (катионы) и отрицательно (анионы) заряженные ионы;
- под воздействием внешнего электрического поля катионы в растворе электролита начнут двигаться к катоду (отрицательному электроду), анионы - к аноду (положительному электроду);
- электролитическая диссоциация является обратимым процессом - параллельно с распадом молекул на ионы идет обратный процесс ассоциации (ионы соединяются в молекулы), в результате чего в растворе устанавливается динамическое равновесие.
Через несколько лет, в 1891 г., русский ученый И. Каблуков внес существенные уточнения в теорию Аррениуса, введя понятие сольватации катионов и анионов (формирование химических связей между растворителем и растворяемым веществом).
| Электролитической диссоциацией (ионизацией) называют процесс распада электролитов на ионы в водном растворе (расплаве) |
Ионами называют атомы (группы атомов), которые имеют заряд (положительный - анионы или отрицательный - катионы).
Ионы бывают:
- простые - Na+, Mg2+, S2-, Cl-
- сложные - NO3-, NH4+, SO42-, PO43-
| Растворы электролитов нейтральны потому, что общая сумма зарядов анионов всегда равна общей сумме зарядов катионов |
Механизм электролитической диссоциации
Электролиты бывают двух видов: раствором с ионной связью и раствором с ковалентной связью.
Растворители, в которых протекает процесс диссоциации, обязательно состоят из полярных молекул.
Механизм диссоциации электролитов с ионной и ковалентной связью различен.
Диссоциация хлорида натрия
Хлорид натрия является веществом с ионной связью, в узлах кристаллической решетки NaCl находятся ионы натрия и хлора.
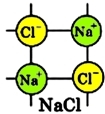
Рис. 1. Кристаллическая решетка хлорида натрия.
При погружении поваренной соли в воду на первой стадии растворения (диссоциации NaCl) полярные молекулы воды под действием электростатического притяжения приклеиваются своей отрицательной стороной к катионам натрия (Na+), а положительной стороной к анионам хлора (Cl-):
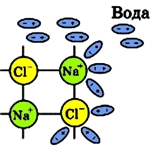
Рис. 2 Притяжение полярных молекул воды к ионам NaCl.
По мере склеивания молекул воды с ионами натрия и хлора происходит ослабление ионных связей Na+ с Cl-:
Кристаллическая решетка постепенно разрушается, в результате чего, освободившиеся ионы переходят в раствор, в котором они тут же связываются с молекулами воды - такие ионы называются гидратированными.
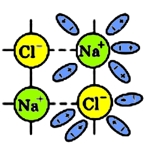
Рис. 3 Ослабление ионных связей хлорида натрия.
Ионные связи хлорида натрия разрываются и гидратированные ионы переходят в раствор:
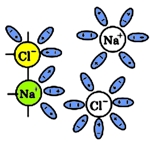
Рис. 4 Переход гидратированных ионов натрия и хлора в раствор.
В водном растворе диссоциация ионных соединений всегда протекает полностью.
Диссоциация хлороводорода
Хлороводород является веществом с ковалентной полярной связью.
Под воздействием молекул воды ковалентные связи поляризуются еще больше и становятся связями ионными, после чего происходит процесс, описанный выше:
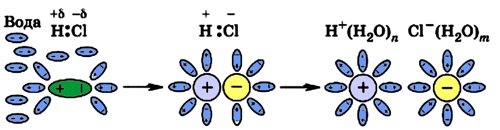
Рис. 5 Диссоциация полярной молекулы HCl.
Из вышесказанного можно сделать вывод, что электролитическая диссоциация возможна в полярных растворителях (вода, этиловый спирт). При диссоциации в первую очередь разрываются наиболее полярные связи (самая большая разность в электроотрицательности атомов, составляющих связь; см. Понятие электроотрицательности).
Растворитель выполняет не только роль разделения катионов и анионов растворяемого вещества, но также замедляет обратный процесс ассоциации ионов в исходную молекулу, поскольку сольватированные (гидратированные) ионы окружены "прилипшими" молекулами растворителя, что мешает сближению (под воздействием кулоновского электростатического притяжения) и воссоединению в молекулу катионов и анионов. Кол-во молекул растворителя, находящихся в гидратной оболочке ионов, зависит от природы ионов, концентрации и температуры раствора.
Одно из главных отличий диссоциации электролитов с полярной связью от диссоциации электролитов с ионной связью заключается в том, что такая диссоциация может быть частичной - это зависит от полярности связей в молекулах электролитов.
Уравнения электролитических диссоциаций записываются следующим образом:
NaCl ↔ Na+ + Cl- HCl ↔ H+ + Cl-
Электролитическая диссоциация протекает за счет энергии, выделяемой в процессе разрушения кристаллической решетки растворяемого вещества во время взаимодейтсвия молекул растворителя с веществом. Следует сказать, что диссоциация может протекать и без растворителя, например, при высокой температуре, когда образуется расплав вещества (энергия для разрушения кристаллической решетки берется из внешнего источника высокой температуры).
ИТОГ: Электролитическая диссоциация - это процесс распада вещества (электролита) на ионы (в растворах под воздействием полярных молекул растворителя; в расплавах - под воздействием высокой температуры).
Свойства ионов
Атомы элементов и их ионы - это далеко не "родственники". По своим физическим и химическим свойствам ионы сильно отличаются от нейтральных атомов, из которых они образовались.
Такие сильные различия между атомами и их ионами объясняются разным электронным строением.
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
- пример диссоциации с образованием осадков:
BaCl2+Na2SO4 = BaSO4↓+2NaCl Ba2++2Cl-+2Na++SO42-=BaSO4↓+2Na++2Cl- 2Cl- и 2Na+ можно сократить Сокращенное ионное уравнение: Ba2++SO42-=BaSO4↓
- пример диссоциации с образованием газов:
CaCO3+2HCl = CaCl2+CO2↑+H2O Сокращенное ионное уравнение: CaCO3+2H+=Ca2++CO2↑+H2O
- пример диссоциации с образованием слабых электролитов:
HCl+NaOH = NaCl+H2O Сокращенное ионное уравнение: H++OH- = H2O
См. далее: Как составлять уравнения ионных реакций...
