Как составлять уравнения ионных реакций
Знания, необходимые для составления уравнений ионных реакций:
- умение отличать электролит от неэлектролита;
- умение составлять уравнения диссоциации электролитов;
- умение устанавливать значение зарядов ионов.
Необходимая информация:
Таблица растворимости:
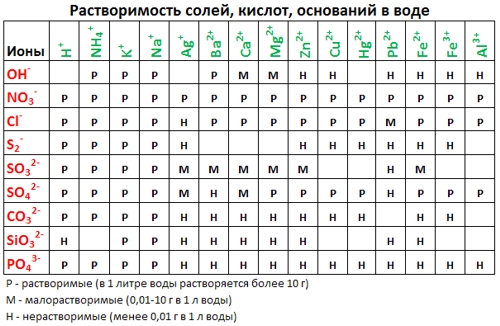
Таблица электрохимического ряда напряжений металлов:

В ионных уравнениях химические формулы веществ записывают в двух видах - в виде ионов, либо в виде молекул. Возникает естественный вопрос, - когда то или иное вещество надо записывать в виде иона или молекулы?
В виде ионов записывают формулы следующих веществ:
- сильные кислоты: H2SO4, HNO3, HI...;
- сильные основания: KOH, NaOH, Ba(OH)2...;
- растворимые в воде соли: KNO3, BaCl2, NaBr...
В виде молекул записывают формулы следующих веществ:
- вода;
- слабые кислоты: HCN, H2SO3, H3PO4...;
- слабые основания: NH4OH, Cu(OH)2, Fe(OH)3...;
- малорастворимые соли: AgCl, CaCO3, FeS...;
- амфотерные гидроксид: Al(OH)3, Cr(OH)3, Zn(OH)2...;
- газообразные вещества: CO2, H2, NH3,...;
- оксиды металлов и неметаллов: CaO, Na2O, P2O5,...
В случае, если среди продуктов реакции имеются нерастворимые или малорастворимые вещества (осадок), возле таких веществ ставят стрелку вниз (↓). Газообразные и летучие соединения соответственно обозначаются стрелкой, направленной вверх (↑).
Алгоритм составления уравнения ионных реакций
- Записать уравнение в молекулярной форме:
CaCl2+Na2CO3 = CaCO3+2NaCl
- В тех случаях, когда реакция идет не до конца, у продуктов реакции, выпадающих в осадок или выделяющихся в виде газа, ставят стрелку:
CaCl2+Na2CO3 = CaCO3↓+2NaCl
- Записывают уравнение в ионном виде для тех веществ, которые диссоциируют на ионы, с указанием их зарядов:
Ca2++2Cl-+2Na++CO32-=CaCO3↓+2Na++2Cl-
- Определяют наличие одинаковых ионов в левой и правой части уравнения - это ионы, не принимающие участия в реакции, поэтому, их можно убрать, такая форма записи ионного уравнения называется сокращенной:
Ca2++CO32-=CaCO3↓
НАДО ПОМНИТЬ:
- ионы водорода и металлов имеют положительный заряд;
- ионы гидроксония и кислотных остатков - отрицательный заряд;
- как правило, заряд иона численно равен валентности атома.
Составление молекулярных уравнений по ионным
Теперь рассмотрим обратную задачу - как составить молекулярное уравнение, если известно сокращенное ионное уравнение.
- Дано сокращенное ионное уравнение взаимодействия между фосфором и хлором:
Pb2++2Cl- → PbCl2↓
- По таблице Растворимостей (см. выше) подбираем соответствующие вещества, содержащие нужный катион и анион - хлорид натрия (NaCl) и нитрат свинца (II) (Pb(NO3)2);
- Пишем формулы выбранных веществ, которые должны прореагировать:
NaCl+Pb(NO3)2
- Пишем формулы получившихся в результате реакции веществ:
NaCl+Pb(NO3)2 → PbCl2↓+NaNO3
- Осталось расставить стехиометрические коэффициенты, чтобы уравнять кол-во вещества в левой и правой части уравнения:
2NaCl+Pb(NO3)2 = PbCl2↓+2NaNO3
Реакции обмена в водных растворах электролитов могут протекать до конца (необратимые реакции)) или же одновременно протекать в противоположных направлениях (обратимые реакции).
Условия протекания необратимых реакций:
- образование осадка;
- выделение газа;
- образование малодиссоциирующего вещества (например, воды).
В случае, если в растворе нет ионов, способных связаться между собой, реакция является обратимой, т.е., не протекает до конца.
Пример необратимой реакции с выпадением осадка был приведен выше - взаимодействие хлорида натрия и нитрата свинца (II).
Пример необратимой реакции с выделением газа - взаимодействие карбоната натрия и соляной кислоты:
Na2CO3+2HCl = 2NaCl+H2CO3+CO2↑ CO32-+2H+ → H2O+CO2↑
Пример необратимой реакции с образованием воды - взаимодействие гидроксида калия и азотной кислоты:
KOH+HNO3 = KNO3+H2O H++OH- → H2O
Пример обратимой реакции взаимодействия слабого электролита (CH3COOH) и нерастворимого основания (Cu(OH)2):
CH3COOH+KOH↔CH3COOK+H2O CH3COOH+OH-↔CH3COO-+H2O Cu(OH)2+2HCl↔CuCl2+2H2O Cu(OH)2+2H+↔Cu2++2H2O
Если в реакцию вступают сильные электролиты, не дающие в результате взаимодействия малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают - в растворе образуется смесь ионов, которые никак не взаимодействуют друг с другом:
2NaCl+Ca(NO3)2 ≠ 2NaNO3+CaCl2 2Na++2Cl-+Ca2++2NO3- ≠ 2Na++2NO3-+Ca2+-
Левая и правая части уравнения содержат абсолютные одинаковые ионы, которые можно сократить, поэтому никакой реакции не происходит.
См. далее: Степень и константа диссоциации...
