Основное и возбужденное состояние атома
Почему одни атомы могут иметь только одну валентность, а другие - несколько? Для ответа на этот вопрос обратимся к квантово-механической модели строения атома, согласно которой, электроны вокруг атомного ядра располагаются на, так называемых, энергетических уровнях (см. Электронная структура атомов).
Как известно, атомы могут вступать в химические реакции с другими атомами, с образованием химических связей, путем отдачи/принятия своих/чужих электронов, которые называются валентными (см. Валентность).
В Периодической таблице химических элементов Д. И. Менделеева все атомы отображены в их основном состоянии (состоянии с минимальной энергией). Основное состояние атома описывается электронной конфигурацией атома, согласно его положению в Периодической таблице (см. Таблицу электронных конфигураций атомов химических элементов по периодам.
В определенных ситуациях, некоторые атомы, получая энергию извне, переходят в, так называемое, возбужденное состояние, в котором пребывают относительно короткое время, поскольку возбужденное состояние является нестабильным, после чего возбужденный атом отдает энергию и возвращается в свое основное (стабильное) состояние.
Рассмотрим основное и возбужденное состояние атома на конкретных примерах.
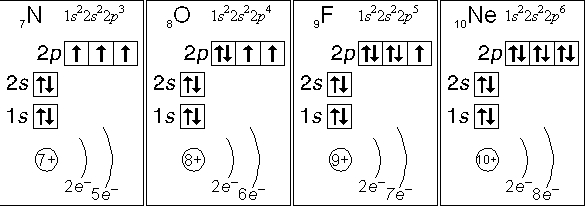
Рис. Электронные конфигурации атомов азота, кислорода, фтора, неона.
- атом азота (N):
- кол-во неспаренных электронов: 3
- ковалентность: 3
- атом кислорода (О):
- кол-во неспаренных электронов: 2
- ковалентность: 2
- атом фтора (F):
- кол-во неспаренных электронов: 1
- ковалентность: 1
- атом неона (Ne):
- кол-во неспаренных электронов: 0
- ковалентность: 0
Азот, кислород, фтор и неон не могут иметь возбужденного состояния по той простой причине, что они не имеют свободной орбитали с более высокой энергией, на которую могли бы "перескакивать" спаренные электроны с орбиталей с меньшей энергией.
Рассмотрим атом серы, который находится в одной с кислородом группе - 16 (VIa), но, в отличие от кислорода, у атома серы имеется свободная d-орбиталь, существенно расширяющая валентные возможности элемента:
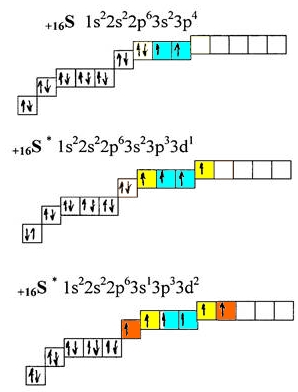
Рис. Возбужденное состояние атома серы.
В основном состоянии атом серы имеет 2 валентных электрона (голубой цвет). Как видно из вышеприведенного рисунка, получая энергию извне, у атома серы могут появляться еще 2 (желтый цвет) или 4 (желтый+оранжевый) дополнительных валентных электрона, при этом общее кол-во валентных электронов увеличивается до 4 или 6 соответственно.
