Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) - сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) - серный ангидрид
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
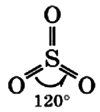
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
В жидком и твердом состоянии происходит полимеризация молекул:
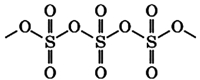
Физические свойства серного ангидрида:
- бесцветная жидкость;
- при температуре менее 16,8°C серный ангидрид превращается в белую кристаллическую массу;
- обладает высокой гигроскопичностью.
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
- с основаниями реагирует с образованием гидросульфатов (кислых солей) и сульфатов (средних солей):
SO3+Na2O = Na2SO4 SO3+2NaOH = Na2SO4+H2O
- с основными оксидами реагирует с образованием сульфатов:
SO3+CaO = CaSO4
- с водой реагирует бурно, при этом образуется серная кислота:
SO3+H2O = H2SO4
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
H2SO4+nSO3 = H2SO4·nSO3
При n=1 образуется пиросерная кислота H2S2O7.
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
3S+6O3+H2S-2 = 4S+4O2+H2O
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
2SO2+O2 = 2SO3
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
