Атомы элементов 14(IVa) группы
| Элемент | C | Si | Ge | Sn | Pb |
|---|---|---|---|---|---|
| Порядковый номер | 6 | 14 | 32 | 50 | 82 |
| Атомная масса (относительная) | 12,011 | 28,0855 | 72,59 | 118,69 | 207,2 |
| Плотность (н.у.), г/см3 | 2,25 | 2,33 | 5,323 | 7,31 | 11,34 |
| tпл, °C | 3550 | 1412 | 273 | 231 | 327,5 |
| tкип, °C | 4827 | 2355 | 2830 | 2600 | 1749 |
| Энергия ионизации, кДж/моль | 1085,7 | 786,5 | 762,1 | 708,6 | 715,2 |
| Электронная формула | [He]2s22p2 | [Ne]3s23p2 | [Ar]3d104s24p2 | [Kr]4d105s25p2 | [Xe]4f145d106s26p2 |
| Электроотрицательность (по Поллингу) | 2,55 | 1,9 | 2,01 | 1,96 | 2,33 |
Электронные формулы инертных газов:
- He - 1s2;
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - [Ar]3d104s24p6;
- Xe - [Kr]4d105s25p6;
Рис. Строение атома углерода.
В 14 группу (IVa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 5 элементов: углерод, кремний, германий, олово, свинец (см. таблицу выше). Углерод и кремний - неметаллы, германий является веществом, проявляющим металлические свойства, олово и свинец - типичные металлы.
Самым распространенным в земной коре элементом 14(IVa) группы является кремний (второй после кислорода элемент по распространенности на Земле) (27,6% по массе), далее идут: углерод (0,1%), свинец (0,0014%), олово (0,00022%), германий (0,00018%).
Однако, по важности, ни один из элементов не может составить "конкуренцию" углероду, который составляет основу жизни на Земле, образуя колоссальное количество органических соединений (см. Органическая химия). В качестве неорганики углерод встречается, как в свободном состоянии (алмаз, графит, фуллерен), так и в соединениях (карбонаты, углеводороды), а также входит в углекислый газ (массовая доля в земной атмосфере 0,012%). Подробнее см. Углерод и его соединения...
Кремний, в отличие от углерода, в свободном виде в природе не встречается, его можно найти только в связанном виде:
- SiO2 - кремнезём, встречается в виде кварца (входит в состав многих горных пород, песка, глины) и его разновидностей (агат, аметист, горный хрусталь, яшма и пр.);
- богаты кремнием силикаты: тальк, асбест;
- алюмосиликаты: полевой шпат, слюда, каолин.
Подробнее см. Кремний и его соединения...
Германий, олово и свинец также в свободном виде в природе не встречаются, а входят в состав некоторых минералов:
- германий: (Cu3(Fe, Ge)S4) - минерал германит;
- олово: SnO2 - касситерит;
- свинец: PbS - галенит; PbSO4 - англезит; PbCO3 - церуссит.
Все элементы 14(IVa) группы в невозбужденном состоянии на внешнем энергетическом уровне имеют два неспаренных p-электрона (валентность равняется 2, например, CO). При переходе в возбужденное состояние (процесс требует энергетических затрат) один спаренный s-электрон внешнего уровня "перескакивает" на свободную p-орбиталь, образуя, таким образом, 4 "одиноких" электрона (один на s-подуровне и три на p-подуровне), что расширяет валентные возможности элементов (валентность равняется 4: например, CO2).
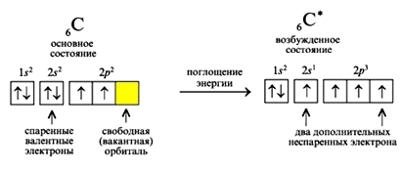
Рис. Переход атома углерода в возбужденное состояние.
По вышеуказанной причине элементы 14(IVa) группы могут проявлять степени окисления: +4; +2; 0; -4.
Поскольку для "перескока" электрона с s-подуровня на p-подуровень в ряду от углерода к свинцу требуется все больше и больше энергии (для возбуждения атома углерода требуется гораздо меньше энергии, чем для возбуждения атома свинца), то углерод "охотнее" вступает в соединения, в которых проявляет валентность четыре; а свинец - два.
То же самое можно сказать и о степенях окисления: в ряду от углерода к свинцу проявление степеней окисления +4 и -4 уменьшается, а степень окисления +2 возрастает.
Поскольку углерод и кремний являются неметаллами, они могут проявлять, как положительную, так и отрицательную степень окисления, в зависимости от соединения (в соединениях с более электроотрицателными элементами C и Si отдают электроны, и получают в соединениях с менее электроотрицательными элементами):
C+2O, C+4O2, Si+4Cl4 C-4H4, Mg2Si-4
Ge, Sn, Pb, как металлы в соединениях всегда отдают свои электроны:
Ge+4Cl4, Sn+4Br4, Pb+2Cl2
Элементы группы углерода образуют следующие соединения:
- неустойчивые летучие водородные соединения (общая формула ЭH4), из которых только метан CH4 является устойчивым соединением.
- несолеобразующие оксиды - низшие оксиды CO и SiO;
- кислотные оксиды - высшие оксиды CO2 и SiO2 - им соответствуют гидроксиды, являющиеся слабыми кислотами: H2CO3 (угольная кислота), H2SiO3 (кремниевая кислота);
- амфотерные оксиды - GeO, SnO, PbO и GeO2, SnO2, PbO2 - последним соответствуют гидроксиды (IV) германия Ge(OH)4, стронция Sn(OH)4, свинца Pb(OH)4;
