Титан, цирконий, гафний: получение
Простые вещества Ti, Zr, Hf получают промышленным способом в результате реакции металлотермического ступенчатого восстановления хлоридов, фторидов, фторидных комплексов, роль восстановителя играют магний, кальций или натрий:
MeCl4+2Mg → Me+2MgCl2 (900°C; Me=Ti,Zr,Hf) MeF4+2Ca → Me+2CaF2 (850°C; Me=Zr,Hf) K2[MeF6]+4Na → Me+4NaF+2KF (750°C; Me=Zr,Hf)
Процесс восстановления идет через стадии образования низших галогенидов.
Оксиды титана, циркония и гафния не подвергают восстановлению по причине очень высоких температур плавления этих веществ и низкой химической активности. Например, водород при температуре 900°C восстанавливает TiO2 только до Ti3O5.
Процесс восстановления титана, циркония и гафния проводят в атмосфере инертного газа (аргона или гелия), поскольку, при высокой температуре эти металлы вступают в реакцию с кислородом и азотом, которые в большом количестве содержатся в атмосферном воздухе.
Получившуюся пористую массу металла, в котором содержатся примеси непрореагировавшего восстановителя, очищают 1%-м раствором соляной кислоты или нагреванием в вакууме, в результате чего летучие металлы и галогениды испаряются, после этого "чистая" титановая (циркониевая, гафниевая) губка переплавляется в слиток в электропечи.
Металл высокой чистоты (содержание примесей менее 0,1%) получают при помощи метода йодидного рафинирования, который был изобретен в 1925 году голландцем А.ван Аркелем.
На рисунке ниже показана схема реактора для йодидного рафинирования титана.
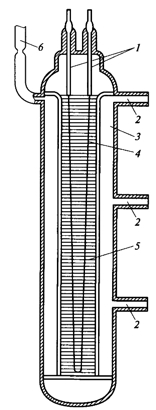
Ti(т)+2I2(г) ↔ TiI4(г) (200°C)
Неочищенную титановую губку с небольшим количеством йода подают в вакуумированный сосуд (3) через трубки (2), где нагревают до 200°C. В результате этого процесса (уравнение см. выше) образующиеся пары галогенида, проходя через решетку (5), разогретую до 1400°C титановой (вольфрамовой) нитью (4), осаждаются на ней в виде крупных кристаллов, а выделившийся при этом йод, возвращается назад и вступает в реакцию с новыми порциями титановой губки. Готовый продукт выводится через вакуумный вывод (6). Таким образом, йод выполняет транспортную роль, доставляя "грязный" металл из холодной зоны в горячую, после чего "возвращается" назад и повторяет процесс, называемый химической транспортной реакцией.
Интересно, что в сосуде должна строго поддерживаться температура около 200°, поскольку при ее повышении до 300° будет протекать совершенно другая реакция с образованием дийодида TiI2, который имеет намного меньшую летучесть по сравнению с тетрайодидом TiI4, поэтому, скорость осаждения титана на вольфрамовой нити практически будет нулевой. Повысить летучесть дийодида можно дальнейшим нагревом стенок реактора до температуры 520°.
Технология получения титана
Титан получают из рутиловых (TiO2) и ильменитовых руд (FeTiO3), содержащих большое количество магнетита Fe3O4. Для очистки руд применяют метод магнитной сепарации, основанный на высоких ферромагнитных качествах оксида железа.Хлорид титана TiCl4 получают вскрытием обогащенного концентрата хлорированием в присутствии углерода:
TiO2+2Cl2+2C → TiCl4+2CO (900°C) 2FeTiO3+7Cl2+6C → 2TiCl4+2FeCl3+6CO (900°C)
Образовавшиеся хлориды нетрудно разделить по причине их разных температур кипения.
Полную очистку тетрахлорида титана от примесей хлорида железа проводят пропусканием смеси через колонку с твердым хлоридом натрия, поглощающим FeCl3 или через активированный уголь, который задерживает хлорид железа.
Оксид титана (IV) получают кислотным вскрытием ильменита, для этого концентрат руды обрабатывают горячей концентрированной кислотой:
2FeTiO3+6H2SO4 → Fe2(SO4)3+2TiOSO4+SO2↑+6H2O
Поскольку реакция является экзотермической, получаемые продукты реакции сильно разогреваются, и при выщелачивании горячей водой титан в виде кислоты выпадает в осадок, при этом "ненужное" железо остается в растворе:
TiOSO4+(x+1)H2O → TiO2·xH2O↓+H2SO4
Получившийся осадок фильтруют, промывают водой и прокаливают при температуре 800°C:
TiO2·xH2O = TiO2+xH2O
Для полного удаления оставшихся примесей железа в раствор добавляется нужное количество опилок, которые восстанавливают Fe3+ в Fe2+, при этом в кислой среде осадок гидроксида железа (II), в отличие от гидроксида железа (III), не образуется:
Fe2(SO4)3+Fe = 3FeSO4
Оксид титана также получают окислением тетрахлорида титана кислородом:
TiCl4+O2 → TiO2+2Cl2 (1000°C)
Технология получения циркония и гафния
Цирконий и гафний получают из островного ортосиликата циркона ZrSiO4, в котором примерно один из ста атомов циркония замещен атомом гафния.
Циркон обладает очень прочной кристаллической решеткой, поэтому, он устойчив к действию даже концентрированных растворов кислот.
Методы извлечения циркония и гафния из циркона:
- Карбонатный метод (спекание с содой):
ZrSiO4+3Na2CO3 → Na2ZrO3+Na4SiO4+3CO2↑ (1000°C)
- Щелочной метод (сплавление с щелочами):
ZrSiO4+6NaOH → Na2ZrO3+Na4SiO4+3H2O↑ (500°C)
- Фторидный метод (спекание с фторосиликатами):
ZrSiO4+K2SiF6 → K2ZrF6+2SiO2 (700°C)
- Хлоридный метод (хлорирование в присутствии углерода):
ZrSiO4+4Cl2+4C → ZrCl4+SiCl4+4CO (900°C)
Применение титана, циркония, гафния
Титан является важным конструкционным материалом, который нашел широкое применение в изготовлении самолетов, ракет, подводных лодок, химических реакторов, газотурбинных двигателей.
Столь широкое применение титана обусловлено его уникальными качествами:
- титан обладает высокой термической, механической и коррозионной стойкостью, но при этом он вдвое легче стали;
- титан химически устойчив к действию морской воды, растворов щелочей;
- при нагревании до 300°C титановые сплавы на порядок прочнее алюминиевых;
- введение легирующих добавок повышает, и без того высокие механические свойства титана, например, добавка 3-6% алюминия повышает втрое прочность, стойкость к растрескиванию, а коррозионную стойкость становится в 15 раз выше, чем у нержавеющей стали;
- титан является биологически инертным веществом, поэтому, нашел широкое применение в качестве разнообразных протезов, вживляемых в организм человека.
Цирконий, очищенный от гафния, обладает малым сечением захвата нейтронов, поэтому, его используют в качестве оболочек ТВЭЛов (тепловыделяющих элементов), содержащих ядерное топливо для атомных реакторов.
Гафний, наоборот, имеет большое сечение захвата тепловых нейтронов, поэтому, его используют в качестве поглотителя нейтронов, регулируя тем самым мощность ядерных реакторов.
Цирконий и гафний широко применяются в качестве легирующих добавок к различным сплавам (титановым, вольфрамовым, железо-никелевым), в результате чего такие сплавы сохраняют свои высокие механические прочностные качества и коррозионную стойкость при нагревании до высоких температур (1000°C).
Карбиды и нитриды циркония и гафния имеют очень высокую температуру плавления (4200°C), и постепенно вытесняют карбиды ниобия, тантала и вольфрама в качестве износостойких материалов для изготовления поверхностей режущего инструмента (наконечников сверл и буров).
