Атомы элементов 16(VIa) группы (халькогены)
| Элемент | O | S | Se | Te | Po |
|---|---|---|---|---|---|
| Порядковый номер | 8 | 16 | 34 | 52 | 84 |
| Атомная масса (относительная) | 15,9994 | 32,066 | 78,96 | 127,6 | 208,9 |
| Плотность (н.у.), г/см3 | 1,42897 | 2,070 | 4,79 | 6,24 | 9,196 |
| tпл, °C | -218,4 | 112,8 | 117 | 450 | 254 |
| tкип, °C | -182,96 | 444,674 | 585 | 990 | 962 |
| Энергия ионизации, кДж/моль | 1313,1 | 999,6 | 940,9 | 869,3 | 813 |
| Электронная формула | [He]2s22p4 | [Ne]3s23p4 | [Ar]3d104s24p4 | [Kr]4d105s25p4 | [Xe]4f145d106s26p4 |
| Электроотрицательность (по Поллингу) | 3,44 | 2,58 | 2,55 | 2,1 | 2,0 |
Электронные формулы инертных газов:
- He - 1s2;
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - [Ar]3d104s24p6;
- Xe - [Kr]4d105s25p6;
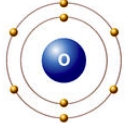
Рис. Строение атома кислорода.
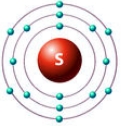
Рис. Строение атома серы.
В 16 группу (VIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 5 элементов: кислород, сера, селен, теллур, полоний. Первые три элемента являются неметаллами; теллур проявляет металлические свойства; полоний является металлом.
Элементы, входящие в группу кислорода, еще называют халькогены ("образующие руды").
Простые вещества, образуемые халькогенами:
- O2 - кислород, газ без цвета и запаха;
- S - сера, кристаллы желтого цвета;
- Se, Te, Po - твердые вещества с металлическим блеском.
У всех халькогенов на внешнем энергетическом уровне находится 6 электронов: 2 (спаренных) на s-подуровне и 4 (два спаренных и два неспаренных) на p-подуровне + свободная орбиталь d-подуровня (исключение составляет кислород, не имеющий d-орбитали, см. Кислород и его соединения).
Наличие свободной d-орбитали значительно расширяет валентные возможности халькогенов.
В невозбужденном состоянии халькогены для завершения своего внешнего энергетического уровня принимают два электрона, проявляя степень окисления -2 (H2S; Na2S).
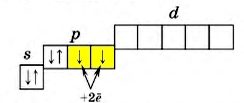
Переходя в возбужденное состояние (что требует относительно небольших энергозатрат), атом халькогена "перебрасывает" один из спаренных p-электронов на d-подуровень, что дает ему возможность образовывать сразу 4 ковалентные связи, проявляя степень окисления +4 (SO2; H2SO3).
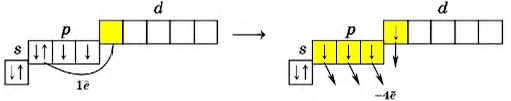
Атомы халькогенов могут "перебрасывать" в возбужденном состоянии сразу два электрона на свободный d-подуровень (1 s-электрон и 1 p-электрон), что дает им возможность образовывать сразу 6 ковалентных связей, проявляя степень окисления +6 (SO3; H2SO4).
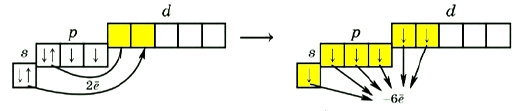
Поскольку в невозбужденном состоянии атомы халькогенов имеют 2 неспаренных электрона на p-подуровне, то характерная валентность их равна 2, а для кислорода - это постоянная валентность. Это обстоятельство объясняется отсутствием у кислорода на внешнем энергетическом уровне d-подуровня. Что касается остальных электронов, расположенных на втором энергетическом уровне, для их перехода на следующий энергетический уровень требуется очень много энергии.
У остальных халькогенов спаренные электроны, расположенные на s- и p-орбиталях, могут достаточно легко возбуждаться с переходом на d-подуровни, что приводит к увеличению кол-ва неспаренных электронов, и, соответственно, валентности элементов.
Все халькогены являются окислителями, но не такими сильными, как галогены - атомы халькогенов присоединяют по два электрона в соединениях с водородом и атомами металлов,проявляя отрицательную степень окисления -2:
Ca+2O-2, Al2+3S3-2, H2+1Se-2, H2+1Te-2
Окислительная способность халькогенов уменьшается по направлению от кислорода к теллуру.
Халькогенид-ионы являются восстановителями, поскольку могут только отдавать электроны, при этом восстановительная способность увеличивается по направлению от кислорода к теллуру.
Соединения халькогенов с водородом:
- H2O - вода;
- H2S - сероводород;
- H2Se - селеноводород;
- H2Te - теллуроводород.
Все халькогеноводороды являются газами при н.у., исключение составляет только вода.
При растворении в воде халькогеноводороды образуют следующие кислоты:
- H2S - сероводородная кислота;
- H2Se - селеноводородная кислота;
- H2Te - теллуроводородная кислота.
Кислотные свойства усиливаются от H2S к H2Te.
Оксиды халькогенов: SO2, SO3, SeO2, SeO3, TeO2, TeO3.
Кислотным оксидам соответствуют кислоты:
- H2SO3 и H2SO4 - сернистая и серная кислота;
- H2SeO3 и H2SeO4 - селенистая и селеновая кислота;
- H2TeO3 и H2TeO4 - теллуристая и теллуровая кислота.
Увеличение силы кислот идет снизу-вверх от H2TeO4 к H2SO4.
В кислотных оксидах и в кислотах халькогены проявляют степени окисления +4 и +6.
