Электрохимический ряд напряжений металлов
|
Стандартным электродным потенциалом металла E0 называют разность потенциалов между металлом, который погружен в раствор своей соли (концентрация ионов металла 1 моль/л), и стандартным водородным электродом (при н.у.) |
Понятно, что ничего не понятно.
Разберем более подробно процессы, которые могут происходить при погружении металлической пластины в раствор соли того же металла, из которого изготовлена и сама пластина, которую, в подобных случаях называют электродом.
Возможны два варианта.
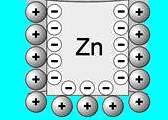
Вариант 1. Электрод изготовлен из металла, являющегося активным восстановителем (ему не "жалко" отдавать свои электроны), пусть это будет, скажем, цинк.
После того, как цинковый электрод погружается в раствор, диполи воды, присутствующие в растворе, начинают притягивать к себе определенную часть атомов цинка, которые переходят в раствор в виде гидратированных ионов, но при этом оставляют свои электроны на поверхности электрода.
Me0+mH2O → Men+·mH2O+ne- Me0 → Men++ne-
Постепенно на поверхности цинкового электрода накапливается все больше и больше "брошенных" отрицательных электронов, - цинковый электрод приобретает отрицательный заряд. Параллельно с этим процессом в растворе увеличивается количество положительно заряженных ионов цинка, которые покинули электрод. Катионы цинка начинают притягиваться отрицательно заряженным электродом, в результате чего на границе электрод-раствор образуется так называемый двойной электрический слой (ДЭС).
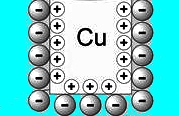
Вариант 2. Электрод изготовлен из металла, который является слабым восстановителем (ему "жалко" расставаться со своими электронами). Пускай роль такого металла играет медь. Таким образом, ионы меди, содержащиеся в растворе, являются сильными окислителями. При погружении медного электрода в раствор часть ионов меди начинает контактировать с поверхностью электрода и восстанавливается за счет свободных электронов, присутствующих в меди.
Men++ne- → Me0
Идет процесс, обратный Варианту 1. Постепенно все больше и больше катионов меди осаждаются на поверхности электрода. Восстанавливаясь, катионы заряжают медную пластину положительно, по мере увеличения заряда положительный медный электрод все больше и больше притягивает отрицательно заряженных ионов, таким образом, формируется двойной электрический слой, но обратной полярности, чем это было в Варианте 1.
Формируемая на границе электрод-раствор разность потенциалов, называется электродным потенциалом.
Измерить такой потенциал очень сложно. Чтобы выйти из трудного положения, решили брать не абсолютные значения, а относительные, при этом в качестве эталона решили взять потенциал водородного электрода, принятый равным нулю.
Потенциал конкретного металлического электрода зависит от природы металла, концентрации и температуры раствора.
Поскольку щелочные и щелочноземельные металлы в водных растворах реагируют с водой - их электродным потенциалы рассчитывают теоретически.
Все металлы принято располагать в порядке возрастания значения их стандартного электродного потенциала - такой ряд называется электрохимическим рядом напряжений металлов:

Что показывает электродный потенциал
Электродный потенциал отражает в численном значении способность металла отдавать свои электроны или восстанавливаться, говоря другими словами, отражает химическую активность металла.
Чем левее в электрохимическом ряду стоит металл (см. выше), тем он легче отдает свои электроны, т.е., является более активным, легче вступает в реакции с другими элементами.
Если брать крайности, то:
- литий самый сильный восстановитель, а ион лития - самый слабый окислитель;
- золото самый слабый восстановитель, а ион золота - самый сильный окислитель.
Следствия, вытекающие из электрохимического ряда напряжений металлов:
- Металл вытесняет из солей все другие металлы, стоящее в ряду правее него (являющиеся более слабыми восстановителями);
- Металлы, имеющие отрицательное значение электродного потенциала, т.е., стоящие левее водорода, вытесняют его из кислот;
- Самые активные металлы, имеющие самые низкие значения электродного потенциала (это металлы от лития до натрия), в водных растворах в первую очередь реагируют с водой.
Следует обратить внимание, что положение металлов в Периодической таблице и положение этих же металлов в электрохимическом ряду напряжений немного отличаются. Данный факт объясняет тем, что значение электродного потенциала зависит не только от энергии, необходимой для отрыва электронов от изолированного атома, но сюда входит также еще и энергия, требуемая для разрушения кристаллической решетки + энергия, которая выделяется при гидратации ионов.
