Электроотрицательность для "чайников"
Электроотрицательность "придумал" американец Л. Полинг, давший в 1932 году такое определение придуманному:
|
Электроотрицательность - способность атома в молекуле притягивать к себе электроны |
Коротко и ясно, и достаточно понятно, если знать строение атома.
"Разжуем" электроотрицательность на простом примере, ибо, ничто не объясняет так теорию, как практика.
Возьмем, всем хорошо известную поваренную соль, или, как говорят химики - хлорид натрия NaCl.
Молекула хлорида натрия образована ионной связью между атомами хлора и натрия (подробнее см. Что такое ионная связь).
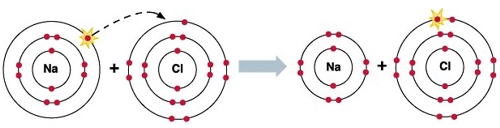
На рисунке хорошо видно, что в образовании молекулы хлорида натрия принимают участие по одному электрону от каждого атома - натрий отдает свой электрон, а хлор его принимает, в результате чего и у натрия, и у хлора завершаются их внешние энергетические слои - все "довольны".
Дотошный читатель может заметить, а чего это натрий отдает свой электрон, а не хлор? Почему происходит именно так, а не наоборот, можно объяснить через электроотрицательность элементов.
Теоретически могут образоваться две молекулы Na+Cl- и Na-Cl+ (отдавая электрон, атом приобретает положительный заряд; получая электрон, атом приобретает отрицательный заряд).
Процесс перехода электрона от одного атома к другому неизбежно связан с затратами энергии.
|
Энергия, затрачиваемая на отрыв электрона от нейтрального атома, называется энергией ионизации (I) |
Как только электрон покинул атом, он тут же присоединяется к другому атому - этот процесс сопровождается выделением энергии.
|
Энергия, выделяющаяся при присоединении электрона к нейтральному атому, называется стродством к электрону (E) |
ВАЖНО! Энергия, затрачиваемая на отрыв электрона от одного атома, и энергия, выделяемая при присоединении электрона к другому атому, НЕ РАВНЫ! I ≠ E
Таким образом, количество затрачиваемой энергии на перенос электрона от одного атома к другому будет равно разности затраченной и выделенной энергии или разности между энергией ионизации и сродством к электрону:
∑ = I-E
Теперь озвучим очень важное правило, согласно которому, возникают те ионы, на образование которых требуется меньше энергии.
Возвращаемся к нашей молекуле хлорида натрия.
Сумма затрат энергии на образование ионов Na+ и Cl- будет равна INa-ECl.
Сумма затрат энергии на образование ионов Na- и Cl+ будет равна ICl-ENa.
Согласно озвученному правилу образования ионов, возникать будут ионы, на образование которых будет требоваться меньше энергии:
INa-ECl <> ICl-ENa
Настало время подставить табличные значения и узнать конкретные цифры:
- INa = 5,14 эВ
- ENa = -0,78 эВ
- ICl = 13,01 эВ
- ECl = -3,61 эВ
5,14-(-3,61) < 13,01-(-0,78) 8,75 < 13,79
Таким образом, мы видим, что на образование молекулы Na+Cl- требуется 8,75 эВ, а на образование молекулы Na-Cl+ требуется 13,79 эВ. Поэтому, образовываться будет молекула Na+Cl-, в которой атом натрия отдает свой электрон, а атом хлора его принимает.
Если провести элементарные алгебраические преобразования, то формулу суммы затрат энергии, можно переписать следующим образом:
INa-ECl <> ICl-ENa или INa+ENa <> ICl+ECl
|
Сумма энергии ионизации атома (I) и сродства к электрону (E) является количественной характеристикой электроотрицательности атома χ = I+E |
Электроотрицательность выражают в эВ/атом или в кДж/моль.
Наибольшей электроотрицательностью обладает атом фтора χF=21,04 эВ, поэтому, фтор является самым электроотрицательным элементом из всей Периодической таблицы.
На практике пользуются относительными значениями электроотрицательности, которые получены делением абсолютных значений электроотрицательности конкретного элемента на электроотрицательность лития.
Смотреть таблицу электроотрицательности элементов...
Почему именно электроотрицательность лития была принята за относительную единицу электроотрицательности? Трудно сказать. По большому значению, не имеет значения электроотрицательность какого элемента принимать за относительную единицу.
Следует обратить внимание, что электроотрицательности атомов в разных источниках могут несколько отличаться друг от друга - это объясняется тем, что их значения рассчитывались различными методами, исходя из конкретных допущений и предположений. Несмотря на небольшие различия, относительное расположение элементов в ряду электроотрицательностей постоянно.Даже беглого взгляда на таблицу электроотрицательностей элементов достаточно, чтобы понять определенную закономерность - электроотрицательность атомов растет в периоде с увеличением его порядкового номера (слева-направо), в группах же, наоборот, электроотрицательность уменьшается сверху-вниз.
| Чем больше относительная электроотрицательность элемента, тем сильнее он проявляет неметаллические свойства |
Условная граница электроотрицательности, разделяющая металлы и неметаллы, равна примерно 2.
Зная значение относительной электроотрицательности элемента, можно приблизительно оценить природу химической связи в соединении.
Максимальной электроотрицательностью обладает атом фтора χF=4,1; минимальной цезий: χCs=0,86. Поэтому, максимальное значение разности электроотрицательностей между любыми двумя элементами Периодической системы, будет равно: Aχ=4,1-0,86=3,24.
- связь атомов с большой разностью электроотрицательности (3,24..1,9) - ионная: соединения с ионной связью имеют высокие температуры кипения и плавления, являются электропроводниками;
- связь атомов с разностью электроотрицательности примерно равно нулю - ковалентная неполярная: соединения имеют низкие температуры плавления и кипения, в воде не диссоциируют на ионы;
- связь атомов с разностью электроотрицательности 1,9..0 - ковалентная полярная: соединения обладают промежуточными свойствами.
По относительной электроотрицательности можно приблизительно оценить прочность химической связи. Например, у галогеноводородов разность Aχ между значением электроотрицательности водорода и галогенами, падает в ряду (соответственно падает и прочность связей):
- HF = 2
- HCl = 0,73
- HBr = 0,64
- HI = 0,11
Поэтому, из солей плавиковой и соляной кислот при их взаимодействии с концентрированной серной кислотой будут вытесняться галогеноводороды, а из солей бромоводородной и йодоводородной кислот, будут также образовываться бром и йод.
Зная относительную электроотрицательность элементов, вступающих в реакцию, можно определить в каком направлении будет происходить переход электронов, т.е., можно определить какой элемент будет играть роль окислителя, а какой - восстановителя.
| Чем больше относительная электроотрицательность элемента, тем сильнее его окислительные свойства, и, наоборот, чем меньше электроотрицательность - тем сильнее проявляются восстановительные свойства. |
В химической номенклатуре, в химических формулах бинарных соединений на первом месте записывают элемент с меньшей электроотрицательностью, называют соединение по элементу с большей электроотрицательностью, добавляя окончание "ид":
- CF4 - фторид углерода;
- NCl3 - нитрид хлора;
- ClBr - хлорид брома;
- CS2 - сульфид углерода, но не карбид серы.
См. далее Степень окисления
