О валентности для "чайников"
Под валентностью понимают способность атома к образованию химической связи. Численно валентность равна количеству электронных пар, которыми атом связывается с другим атомом или атомами.
Количество возможных связей, которые может образовать атом в процессе химической реакции, равно количеству его неспаренных электронов.
ВАЖНО! При определении валентности не имеет значение полярность образующейся связи, поэтому, валентность, в отличие от степени окисления, не имеет знака.
Дальнейшее изложение материала ведется с условием того, что читатель знаком с электронной структурой атомов и степенью окисления.
Разберем, что из себя представляет валентность, на примере атома азота, который имеет следующую электронную конфигурацию: 1s22s22p3.
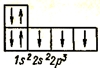
Атом азота имеет три неспаренных электрона, следовательно, его валентность равна 3. Остальные четыре атома азота, располагаются на первом уровне (2), и еще два на 2s-подуровне.
Разберем структурные формулы трех веществ: молекулы азота N2, гидразина N2H4, аммиака NH3. Напомним, что в структурных формулах электронная пара ковалентной связи отображается в виде черточки.
В молекуле азота атомы связываются друг с другом тремя парами неспаренных электронов, таким образом, в этом соединении азот имеет валентность 3,но степень окисления 0.
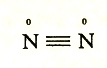
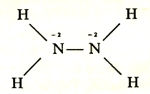
В молекуле гидразина два из трех валентных электронов азот "отдает" для связей с водородом, а третьей парой связывается между собой, таким образом, в этом соединении азот имеет валентность 3, но степень окисления = -2:
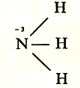
В молекуле аммиака азот выделяет для связи с тремя атомами водорода по одному из своих валентных электронов, проявляя степень окисления -3, а валентность остается той же, т.е., равна 3.
Теперь возьмем ион аммония NH4+, в котором азот образует четыре связи! Как же так, скажет внимательный читатель, ведь у атома азота всего три валентных электрона, откуда взялась четвертая связь? Четвертая связь образуется по донорно-акцепторному механизму, когда водород "предоставляет" азоту свою свободную орбиталь, на которую азот "перебрасывает" свою электронную пару с 2s-подуровня. Поскольку азот образует четыре связи, в ионе аммония он имеет валентность 4, а степень окисления = -3.
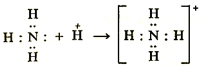
В молекуле азотной кислоты HNO3 оба атома кислорода, связанные только с атомом азота, находятся на одинаковом расстоянии и делят между собой поровну четвертую связь атома азота.
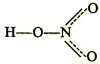
Однако, атом азота может один электрон со своего 2s-подуровня отдать одному из "понравившихся" ему атомов кислорода, в результате чего образуется 4 неспаренных электрона, а атом азота становится четырехвалентным в виде N+.

Неверно изображать молекулу азотной кислоты следующей структурной формулой:
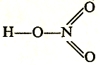
Атом азота в принципе не может образовать пять ковалентных связей, поскольку, для этого понадобится 10 электронов, но у атома азота на внешнем (втором) энергетическом уровне не может находиться более 8 электронов, поэтому, азот в принципе не может иметь валентность V. Но, степень окисления азота в молекуле азотной кислоты = +5.
Атомы бора и фтора в молекуле фторида бора связываются между собой за счет одной ковалентной связи, образованной неспаренными электронами, а также двумя связями, образованными по донорно-акцепторному механизму - бор предоставляет две своих свободных орбитали, на которых фтор размещает свои две электронные пары. В молекуле BF и бор, и фтор, имеют валентности, равные III, при этом, степень окисления фтора = -1 (единственно возможная для него), а бора = +1.

В заключение изложения материала, разберем химическую связь в молекуле угарного газа, имеющего очень прочную химическую связь, что объясняется наличием тройной связи в молекуле CO.
В молекуле оксида углерода (II) атомы кислорода и углерода соединены тройной связью.
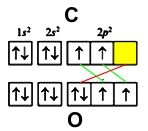
Электронные конфигурации:
- кислорода - 1s22s22p4
- углерода - 1s22s22p2
У обоих элементов имеется по два неспаренных электрона на внешнем энергетическом уровне, которые и образуют две ковалентные связи (обозначены зеленым цветом). Третья связь образуется по донорно-акцепторному принципу - атом углерода (акцептор) предоставляет свою свободную орбиталь (желтая ячейка), на которой размещается электронная пара кислорода (донор) (красный цвет).
В молекуле угарного газа атом углерода принимает валентность 3, но степень окисления +2. По этой причине, для оксида углерода CO(II) характерны реакции присоединения, в которых он играет роль восстановителя:
Из всего вышесказанного, можно сделать очень важный вывод - валентность элемента является достаточно "капризной" штукой и не всегда совпадает с его степенью окисления.
Почему одни атомы могут иметь только одну валентность, а другие - несколько? Для ответа на этот вопрос см. Основное и возбужденное состояние атома...
См. также: Написание формулы по валентности и Определение валентности по готовой формуле.
См. далее Окислительно-восстановительные свойства элементов