Аммиак (NH3)
Молекула аммиака имеет форму пирамиды с углами между связями азот-водород, равными 107°, при этом единственная свободная электронная пара находится на одной из 4-х орбиталей, которые имеют форму неравноплечной "восьмерки", три остальные "заняты" атомами водорода:
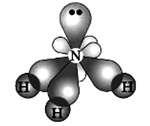
Поскольку атом азота является более электроотрицательным по отношению к атому водорода, то электронные пары связей N-H являются полярными, смещенными к атому азота, в результате чего на атомах водорода возникает частичный положительный заряд, а на атоме азота - отрицательный. По этой причине между молекулами аммиака образуются водородные связи.
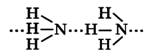
Наличие водородных связей становится причиной того, что аммиак имеет относительно высокие температуры плавления (-77,73°C) и кипения (-33,34°C). При растворении в воде аммиак образует водородные связи с молекулами воды, при этом примерно 4 молекулы из 100 ионизируются, вследствие чего водный раствор аммиака (гидроксид аммония) становится щелочным (10%-й раствор аммиака в воде больше известен, как нашатырный спирт).
NH3+H2O ↔ NH4OH ↔ NH4++OH-
Физические свойства аммиака:
- бесцветный газ с резким запахом;
- легче воздуха;
- хорошо растворяется в воде (1:700);
- молярная масса: 17,031 г/моль;
- плотность: 0,73 кг/м3;
- температура кипения: -33,34°C;
- температура плавления: -77,73°C
Химические свойства аммиака
Аммиак обладает оснОвными свойствами, что объясняется наличием у атома азота неподеленной электронной пары, которая может образовать донорно-акцепторную связь (атом азота в молекуле аммиака способен присоединить катион водорода).
Реакции присоединения с участием аммиака:
- при растворении аммиака в воде происходит образование катиона аммония (NH4+), как следствие, ощелачивание раствора:
NH3+HOH ↔ NH4OH ↔ NH4++OH-
- реагирует с галогеноводородами:
NH3+HCl ↔ NH4Cl (хлорид аммония)
- реагирует с кислотами с образованием средних и кислых солей:
NH3+H3PO4 → (NH4)3PO4 (Фосфат аммония) NH3+H3PO4 → (NH4)2HPO4 (Гидрофосфат аммония) NH3+H3PO4 → (NH4)H2PO4 (Дигидрофосфат аммония)
- реагирует с солями некоторыми металлов с образованием аммиакатов:
CuSO4+4NH3 = [Cu(NH3)4]SO4 AgCl+2NH3 = [Ag(NH3)2]Cl
В окислительно-восстановительных реакциях аммиак проявляет восстановительные свойства, поскольку атом азота в молекуле аммиака имеет степень окисления -3, и может только отдавать электроны, но не принимать их:
- аммиак восстанавливает некоторые металлы из их оксидов:
2N-3H3+3Cu+2O = N20↑+3Cu0+3H2O
- горит в кислороде, восстанавливаясь до азота:
4N-3H3+2O20 = 2N20↑+6H2O-2
- в присутствии катализатора (платина) аммиак окисляется до монооксида азота:
4N-3H3+5O20 = 4N+2O-2+6H2O
Уравнения окислительно-восстановительных реакций аммиака...
С кислотами аммиак вступает в реакцию с образованием солей аммония:
NH3+HCl = NH4Cl NH3+H3PO4 = NH4H2PO4 NH3+HNO3 = NH4NO3 2NH3+H2SO4 = (NH4)2SO4
Соли аммония хорошо растворимы в воде, гидролизуются, реагируют с щелочами и некоторыми солями, проявляя, таким образом, общие свойства солей.
В зависимости от характера аниона, соли аммония по разному разлагаются при нагревании:
NH4Cl = NH3↑+HCl↑ N-3H4N+5O3 = N2+1O↑+2H2O (NH4)2SO4 = NH3↑+NH4HSO4
Качественная реакция на катион аммония (NH4+):
NH4+Cl+NaOH- = NaCl+NH3↑+H2O
Получение и применение аммиака
В промышленных целях аммиак получают из простых веществ:
N2+3H2 = 2NH3
В лабораторных условиях аммиак получают воздействием щелочей на соли аммония при нагревании:
NH4Cl+KOH = NH3↑+KCl+H2O
Применение аммиака:
- при производстве азотной кислоты и ее солей;
- нашатырный спирт и нашатырь применяют в медицине;
- жидкий аммиак и его соли (нитрат аммония, фосфат аммония) применяют в качестве азотных удобрений.
Другие соединения азота:
