Водород (H)

- Обозначение - H (Hydrogen);
- Латинское название - Hydrogenium;
- Период - I;
- Группа - 1 (Ia);
- Атомная масса - 1,00794;
- Атомный номер - 1;
- Радиус атома = 53 пм;
- Ковалентный радиус = 32 пм;
- Распределение электронов - 1s1;
- t плавления = -259,14°C;
- t кипения = -252,87°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,02/-;
- Степень окисления: +1; 0; -1;
- Плотность (н. у.) = 0,0000899 г/см3;
- Молярный объем = 14,1 см3/моль.
Бинарные соединения водорода с кислородом:
Водород ("рождающий воду") был открыт английским ученым Г. Кавендишем в 1766 году. Это самый простой элемент в природе - атом водорода имеет ядро и один электрон, наверное, по этой причине водород является самым распространенным элементом во Вселенной (составляет более половины массы большинства звезд).
Про водород можно сказать, что "мал золотник, да дорог". Несмотря на свою "простоту", водород дает энергию всем живым существам на Земле - на Солнце идет непрерывная термоядерная реакция в ходе которой из четырех атомов водорода образуется один атом гелия, данный процесс сопровождается выделением колоссального количества энергии (подробнее см. Ядерный синтез).
В земной коре массовая доля водорода составляет всего 0,15%. Между тем, подавляющее число (95%) всех известных на Земле химических веществ содержат один или несколько атомов водорода.
Водород "открывает" Периодическую таблицу химических элементов Д. И. Менделеева, находясь в левом верхнем углу таблицы под почетным номером "1".
Главная особенность водорода, отличающая его от остальных элементов Периодической системы, заключается в том, что он "сидит" сразу на двух стульях, - в I и VII группах (в главных подгруппах). Такое "двуличие" водорода объясняется тем, что он имеет много общего, как с щелочными металлами, так и с галогенами. Атом водорода, как и атомы щелочных металлов, может окисляться, превращаясь в катион H+. С другой стороны, как и галогены, атом водорода может присоединять 1 электрон, проявляя свойства восстановителя, превращаясь в гидрид-ион H-.
Водород в ряду электроотрицательности находится аккурат между типичными металлами и типичными неметаллами (электроотрицательность водорода равна 2,1).
Стабильные изотопы водорода:
- протий (1H) - легкий водород, составляет 99,985%;
- дейтерий (2H) - тяжелый водород, 0,015%;
- тритий (3H) - на Земле содержится около 2 кг.
Строение атома водорода проще не придумаешь - вокруг ядра, состоящего из одного протона (заряд +1), вращается по единственной s-орбитали один электрон (см. Электронная структура атомов).
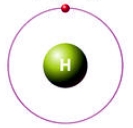
В соединениях с неметаллами (HCl, H2O, CH4...) водород отдает свой единственный электрон более электроотрицательным элементам, проявляя степень окисления +1 (чаще), образуя только ковалентные связи (см. Ковалентная связь).
В соединениях с металлами (NaH, CaH2...) водород, наоборот, принимает на свою единственную s-орбиталь еще один электрон, пытаясь, таким образом, завершить свой электронный слой, проявляя степень окисления -1 (реже), образуя чаще ионную связь (см. Ионная связь), т. к., разность в электроотрицательности атома водорода и атома металла может быть достаточно большой.
H2
В газообразном состоянии водород находится в виде двухатомных молекул, образуя неполярную ковалентную связь.
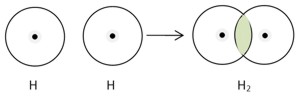
Молекулы водорода обладают:
- большой подвижностью;
- большой прочностью;
- малой поляризуемостью;
- малыми размерами и массой.
Свойства газа водорода:
- самый легкий в природе газ, без цвета и запаха;
- плохо растворяется в воде и органических растворителях;
- в незначительных кол-вах растворяется в жидких и твердых металлах (особенно в платине и палладии);
- трудно поддается сжижению (по причине своей малой поляризуемости);
- обладает самой высокой теплопроводностью из всех известных газов;
- при нагревании реагирует со многими неметаллами, проявляя свойства восстановителя;
- при комнатной температуре реагирует со фтором (происходит взрыв): H2 + F2 = 2HF;
- с металлами реагирует с образованием гидридов, проявляя окислительные свойства: H2 + Ca = CaH2;
В соединениях водород гораздо сильнее проявляет свои восстановительные свойства, чем окислительные. Водород является самым сильным восстановителем после угля, алюминия и кальция. Восстановительные свойства водорода широко используются в промышленности для получения металлов и неметаллов (простых веществ) из оксидов и галлидов.
Fe2O3 + 3H2 = 2Fe + 3H2O
Реакции водорода с простыми веществами
Водород принимает электрон, играя роль восстановителя, в реакциях:
- с кислородом (при поджигании или в присутствии катализатора), в соотношении 2:1 (водород:кислород) образуется взрывоопасный гремучий газ:
2H20+O2 = 2H2+1O+572 кДж
- с серой (при нагревании до 150°C-300°C):
H20+S ↔ H2+1S
- с хлором (при поджигании или облучении УФ-лучами):
H20+Cl2 = 2H+1Cl
- с фтором:
H20+F2 = 2H+1F
- с азотом (при нагревании в присутствии катализаторов или при высоком давлении):
3H20+N2 ↔ 2NH3+1
Водород отдает электрон, играя роль окислителя, в реакциях с щелочными и щелочноземельными металлами с образованием гидридов металлов - солеобразные ионные соединения, содержащие гидрид-ионы H- - это нестойкие кристаллические в-ва белого цвета.
Ca+H2 = CaH2-1 2Na+H20 = 2NaH-1
Для водорода нехарактерно проявлять степень окисления -1. Реагируя с водой, гидриды разлагаются, восстанавливая воду до водорода. Реакция гидрида кальция с водой имеет следующий вид:
CaH2-1+2H2+10 = 2H20+Ca(OH)2
Реакции водорода со сложными веществами
- при высокой температуре водород восстанавливает многие оксиды металлов:
ZnO+H2 = Zn+H2O
- метиловый спирт получают в результате реакции водорода с оксидом углерода (II):
2H2+CO → CH3OH
- в реакциях гидрогенизации водород реагирует с многими органическими веществами.
Более подробно уравнения химических реакций водорода и его соединений рассмотрены на странице "Водород и его соединения - уравнения химических реакций с участием водорода".
Применение водорода
- в атомной энергетике используются изотопы водорода - дейтерий и тритий;
- в химической промышленности водород используют для синтеза многих органических веществ, аммиака, хлороводорода;
- в пищевой промышленности водород применяют в производстве твердых жиров посредство гидрогенизации растительных масел;
- для сварки и резки металлов используют высокую температуру горения водорода в кислороде (2600°C);
- при получении некоторых металлов водород используют в качестве восстановителя (см. выше);
- поскольку водород является легким газом, его используют в воздухоплавании в качестве наполнителя воздушных шаров, аэростатов, дирижаблей;
- как топливо водород используют в смеси с СО.
В последнее время ученые уделяют достаточно много внимания поиску альтернативных источников возобновляемой энергии. Одним из перспективных направлений является "водородная" энергетика, в которой в качестве топлива используется водород, продуктом сгорания которого является обыкновенная вода.
Способы получения водорода
Промышленные способы получения водорода:
- конверсией метана (каталитическим восстановлением водяного пара) парами воды при высокой температуре (800°C) на никелевом катализаторе: CH4 + 2H2O = 4H2 + CO2;
- конверсией оксида углерода с водяным паром (t=500°C) на катализаторе Fe2O3: CO + H2O = CO2 + H2↑;
- термическим разложением метана: CH4 = C + 2H2↑;
- газификацией твердых топлив (t=1000°C): C + H2O = CO + H2↑;
- электролизом воды (очень дорогой способ при котором получается очень чистый водород): 2H2O → 2H2↑ + O2.
Лабораторные способы получения водорода:
- действием на металлы (чаще цинк) соляной или разбавленной серной кислотой: Zn + 2HCl = ZCl2 + H2; Zn + H2SO4 = ZnSO4 + H2↑;
- взаимодействием паров воды с раскаленными железными стружками: 4H2O + 3Fe = Fe3O4 + 4H2↑.
