Электронная структура атомов
- Диаграмма уровней энергии
- Электронная конфигурация
- Валентные электроны
- Таблица распределения электронов в атоме по энергетическим уровням и подуровням
- Таблица электронных конфигураций атомов химических элементов по периодам
Для описания состояния электрона в атоме кроме квантовых чисел используют:
- диаграммы уровней энергии атома;
- электронные формулы или конфигурации.
Диаграмма уровней энергии
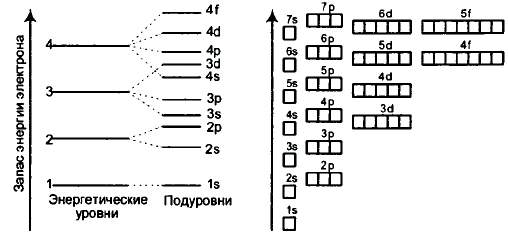
Рис. Энергетические уровни и подуровни атома.
На рисунке показана диаграмма уровней атома, при помощи которой можно описать электроны любого атома.
Энергетические уровни атома (электронные облака, образующие электронные атомные слои) обозначаются цифрами 1, 2, 3, 4...
Энергетические подуровни атома (энергетические уровни, характеризующие энергию связи электрона с атомным ядром) обозначаются буквами s, p, d, f.
Энергетические подуровни могут отображаться в виде квантовых ячеек (рисунок справа): свободных (пустая ячейка); частично заполненных (одна вертикальная стрелочка, направленная вверх или вниз, обозначающая неспаренный электрон); полностью заполненных (две вертикальные разнонаправленные стрелочки, обозначающие спаренные электроны).
Электронная формула атома
Все на диаграммах уровней энергии довольно понятно и наглядно, но громоздко. Используя электронную конфигурацию, диаграмму можно выразить одной короткой строкой.
Рассмотрим атом углерода, который имеет два энергетических уровня, на которых расположено всего 6 электронов (2 - на внутреннем, и 4 - на внешнем):
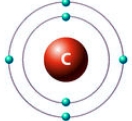
Ниже на рисунках представлены примеры электронных формул атомов углерода и натрия (модель электронной оболочки) и их графическое изображение:
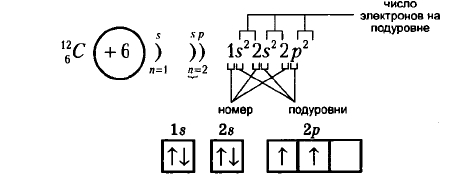
Рис. Электронная формула углерода.
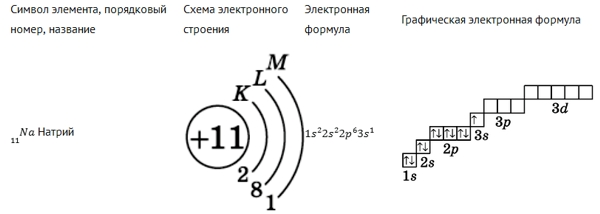
Рис. Электронная формула натрия.
В электронной конфигурации указывается название орбитали энергетического уровня в верхнем индексе которой находится количество электронов, расположенных на этой орбитали.
| Сумма чисел, являющихся верхними индексами, равна порядковому номеру атома, т. е., количеству электронов в атоме. |
Электронная оболочка атома формируется согласно следующих принципов:
- принцип минимума энергии - в первую очередь заполняются орбитали с наименьшей энергией (ближайшие к атомному ядру):
1s; 2s; 2p; 3s; 3p; 4s (3d); 4p; 5s (4d); 5p; 6s (4f) (5d); 6p; 7s; - принцип Паули - на одной атомной орбитали могут находиться не более 2 электронов с противоположными спинами (спаренные электроны);
- правило Хунда - атомные орбитали заполняются таким образом, чтобы сумма их спинов была максимальной.
Например, электронная формула для хлора имеет следующий вид: 1s22s22p63s23p5.
Порядковый номер хлора в таблице - 17. Это значит, что атом хлора содержит 17 протонов и 17 электронов. Т.е., нам на диаграмме надо (согласно правилам) расположить 17 электронов.
Как уже было сказано выше, схематически электрон отображается в виде стрелочки. Если на орбитали находятся два электрона, то они отображаются в виде двух разнонаправленных стрелок (электроны с разными спинами).
- Сначала заполняем самый низкий энергетический уровень: 1s-орбиталь. На ней размещается 2 электрона.
- Следующие 2 электрона занимают 2s-орбиталь.
- Следующий энергетический уровень: 2p-орбиталь - 6 электронов.
- Следующие 2 электрона - 3s-орбиталь.
- Оставшиеся 5 электронов располагаются на 3p-орбитали, образуя две спиновые пары (у последнего электрона пары нет).
Таким образом, диаграмма уровней энергии для хлора будет выглядеть следующим образом:
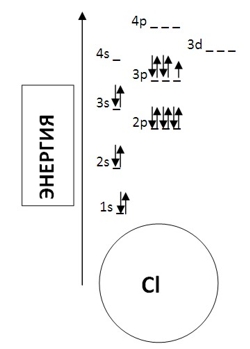
Внимательный читатель, скорее всего, обратил внимание, что порядок заполнения электронных энергетических подуровней в атомах несколько нарушен, например, сначала заполняется подуровень 4s, а только затем 3d. Данное нарушение обясняется правилом Клечковского, которое гласит, что электроны заполняют атомные уровни (подуровни) в порядке возрастания суммы (n + l), в случае, если суммы главного и орбитального квантовых чисел равны, заполнение происходит в порядке увеличения n (см. Квантово-механическая модель строения атома).
- Для подуровня 4s: n+l = 4+0 = 4;
- Для подуровня 3d; n+l = 3+2 = 5.
Подуровни 3d, 4p, 5s имеют равные суммы n+l=5, поэтому заполнение идет в порядке возрастания главного квантового числа: 3d→4p→5s.
Правило Клечковского имеет ряд исключений, когда близкие друг к другу подуровни незначительно отличаются энергией, в таком случае электрон стремится занять подуровень с меньшей энергией, пусть он даже будет "вышележащим", при этом "нижележащий" уровень остается незаполненным. Например 5d1 заполняется раньше, чем 4f.
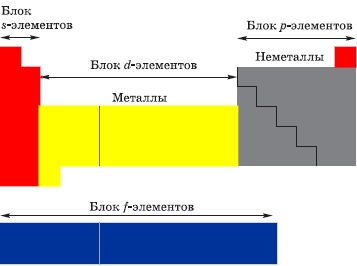
Классификация химических элементов по строению их атомов:
- s-элементы (14): электроны заполняют s-подуровень внешнего уровня - водород, гелий + первые 2 элемента каждого периода;
- p-элементы (30): электроны заполняют p-подуровень внешнего уровня - последние 6 элементов каждого периода;
- d-элементы (32): электроны заполняют d-подуровень второго снаружи уровня - элементы вставных декад больших периодов, которые находятся между s- и p-элементами;
- f-элементы (28): электроны заполняют f-подуровень третьего снаружи уровня - лантаноиды и актиноиды.
Подробнее см. Таблицу электронных конфигураций атомов химических элементов по периодам.
Валентные электроны
Ранее мы говорили, что атом является нейтрально заряженной частицей, поскольку количество электронов и протонов в нем одинаково. Однако, электроны, находящиеся на самых дальних орбиталях, слабо притягиваются положительными протонами, находящимися в ядре атома. Поэтому, атомы элементов способны отдавать и присоединять электроны.
|
Электроны, расположенные на внешнем незавершенном энергетическом уровне, называются валентными электронами. Подробнее см. Валентность. |
НАДО ЗНАТЬ! К валентным относятся внешние электроны, плюс те предвнешние электроны, энергия которых больше, чем у внешних.
См. далее: Масса атомов и молекул, атомная единица массы
