Что такое химическая связь
Ранее уже было сказано, что вещества, в окружающем нас мире, состоят из атомов, молекул и ионов (см. Что такое вещество), однако, только благородные газы присутствуют в виде свободных атомов: гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn). Все другие химические элементы в виде свободных атомов в природе не встречаются, что объясняется неустойчивостью (незавершенностью) их внешних электронных оболочек (см. Электронная структура атомов).
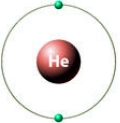
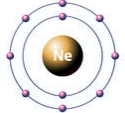
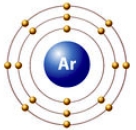
Как видно из рисунков, внешние электронные уровни инертных газов полностью укомплектованы, поэтому они не отдают и не принимают электроны от других химических элементов (не вступают с ними в химические реакции).
Атомы всех других химических элементов (за исключением инертных газов) стремятся завершить свои внешние электронные оболочки, отдавая или принимая электроны от атомов других химических элементов (вступают в химические реакции).
Рассмотрим самый простой химический элемент - водород, который имеет всего один электрон. Как только два атома водорода столкнутся друг с другом, тотчас же будет образована молекула водорода Н2, путем объединения электронов двух атомов. Образуется электронная пара, соединяющая между собой оба атома водорода, которые удерживаются силой химической связи (в молекуле водорода у каждого атома имеется завершенный уровень из двух электронов).
Химической связью называют силу, которая удерживает вместе определенное кол-во атомов (ионов), обеспечивая тем самым стабильность образованной молекулы.
Сила химической связи зависит от электронного строения атомов, которые образуют эту самую связь - чем крепче химическая связь, тем более стабильной является молекула вещества.
Как правило, в установлении химической связи принимают участие электроны, расположенные на внешнем (реже - на предвнешнем) энергетическом уровне. Такие электроны называются валентными (см. Валентность).
Примечательно, что число электронов, расположенных на внешнем электронном уровне, при которых будет сформирована химическая связь, для элементов первого периода периодической таблицы Д. И. Менделеева равняется 2, для второго и третьего = 8, для четвертого и пятого = 18 (что соответствует кол-ву электронов на заполненных оболочках благородных газов).
Электронная теория валентности, разработанная в 1916 г. Дж. Льюисом и В. Косселем, гласит, что при образовании химической связи атомы стремятся сформировать электронную конфигурацию инертного газа.
Эту "задачу" атомы могут "решать" двумя путями:
- за счет потери или приобретения электронов от других атомов (ионная связь);
- за счет совместного использования электронов с другими атомами (ковалентная связь).
