Ковалентная связь
В основу ковалентной связи положен принцип совместного использования электронов, как стремление заполнения валентных уровней энергии.
1. Водород - H2
Обычно в природе водород встречается не в виде отдельного атома, а представляет собой двухатомную молекулу - Н2.
Водород имеет один валентный электрон и ему нужен еще один, чтобы заполнить первый энергетический уровень (электронная формула атома водорода = 1s1; см. Электронная структура атомов). Атом водорода может "позаимствовать" недостающий электрон у другого атома водорода. Но, в таком случае, атом водорода, отдавший свой единственный электрон, станет еще более нестабильным. Поэтому, такой вариант неосуществим.
Единственно возможным вариантом соединения H2 может быть только совместное использование электронов. Два электрона как бы "принадлежат" обоим атомам водорода. Образование химической связи между атомами водорода есть результат перекрытия электронных орбиталей, которое происходит при сближении атомов. Такой вид связи называется ковалентной связью.
| Ковалентная связь - химическая связь, которая образуется за счет совместного использования двумя атомами хотя бы одной пары электронов |
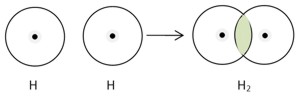
Электронно-точечная формула: H· + ·H → H:H
Структурная формула Льюиса: H· + ·H → H—H
У каждого атома водорода в молекуле формируется конфигурация атома гелия (см. Электронная теория валентности).
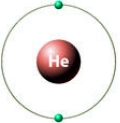
Образование прочной химической связи в молекуле водорода осуществляется за счет перекрывания s-орбиталей атомов, благодаря чему между ядрами атомов водорода создается повышенная электронная плотность, из-за чего электроны молекулы водорода испытывают притяжение одновременно двух ядер.
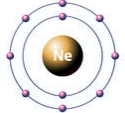
Согласно теории Электронной структуры атомов, атомы химических элементов в молекулах стремятся получить стабильную электронную конфигурацию ближайшего инертного газа. Например, при слиянии атомов фтора в молекулу образуется конфигурация неона:

Кроме водорода в природе существует еще 6 элементов (простых веществ), имеющих двухатомную молекулу: O2, N2, F2, Cl2, Br2, I2.
Ионная связь (ИС) образуется между металлом и неметаллом.
Ковалентная связь (КС) образуется между двумя неметаллами.
У этих связей различные свойства:
- при комнатной температуре соединения с ИС обычно твердые вещества; соединения с КС могут находиться в твердом, жидком и газообразном состоянии;
- точка плавления для ионных соединений обычно намного выше, чем для ковалентных;
- ИС - электролиты (проводят электрический ток); КС - неэлектролиты.
Следует сказать, что ковалентные связи могут возникать также между разными атомами. Например, в молекуле фтороводорода (HF) единственный атом водорода, расположенный на s-орбитали, перекрывается с непарным атомом фтора, который находится на p-орбитали, таким образом, в молекуле HF атом водорода получает электронную конфигурацию He, а атом фтора - конфигурацию Ne.
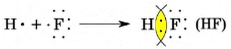
Поскольку у взаимодействующих атомов водорода и фтора различный электроотрицательный заряд, образовавшаяся общая электронная пара смещается к более электроотрицательному атому фтора, с образованием ковалентной полярной связи (в молекулах простых веществ ковалентная связь неполярная).
Выше было рассмотрено образование ковалентной связи за счет общей электронной пары двух атомов. Существует еще один механизм образования ковалентной связи, который называется координационным или донорно-акцепторным.
При донорно-акцепторном механизме образования ковалентной связи химическая связь образуется за счет электронной пары (неподеленной пары электронов), которую поставляет один из атомов (донор), при этом другой атом (акцептор) предоставляет для этой электронной пары свою свободную орбиталь.
2. Множественные связи
Выше были рассмотрены ковалентные связи, использующие один электрон - одиночные связи. Существуют молекулы, в которых есть несколько общих электронных пар, образующих множественную связь.
Кислород (O2) находится в группе VIA и имеет 6 валентных электронов. Для завершения внешнего энергетического уровня ему надо принять 2 электрона. Атом кислорода совместно использует два своих электрона с двумя электронами другого атома кислорода, создавая двойную связь.
Азот (N2) находится в группе VA и имеет 5 валентных электронов. Для завершения внешнего энергетического уровня ему надо принять 3 электрона. Атом азота совместно использует три своих электрона с тремя электронами другого атома азота, создавая тройную связь.
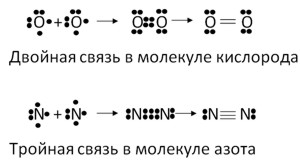
Такая тройная связь намного крепче, чем одинарная - поэтому у азота очень прочная молекула, отсюда низкая активность азота в химических реакциях.
Далее см. Характеристики ковалентной связи...
Мы рассмотрели:
- ионные связи, образующиеся между металлами и неметаллами;
- ковалентные связи, образующиеся между неметаллами.
Могут ли образоваться связи между металлом и металлом? Увы, металл с металлом может образовать только сплав - раствор одного металла в другом.
