Электрохимические элементы
При помещении металлического цинка в раствор сульфата меди происходит окислительно-восстановительная реакция:
Zn(т) + Cu2+ → Zn2+ + Cu(т)
Обе полуреакции (восстановления и окисления) происходят одновременно в месте соприкосновения цинка с раствором. Цинк отдает два электрона катиону меди, окисляясь при этом.
Если же поступить наоборот и поместить металлическую медь в раствор сульфата цинка, то ничего не произойдет. Помните об активности металлов! Цинк является более активным, чем медь - он легче отдает электроны.
В рассмотренном выше примере обе полуреакции протекали в одном месте. А что будет, если разделить полуреакции восстановления и окисления? В этом случае электроны будут переходить от восстановителя к окислителю по внешней цепи, которая будет служить проводником электрического тока. Да-да - направленный поток электронов есть не что иное, как электрический ток.
Устройство преобразования энергии химических реакций в электроэнергию, называются гальваническими элементами, или, говоря простым языком, - электрическими батарейками.
1. Элемент Даниэля
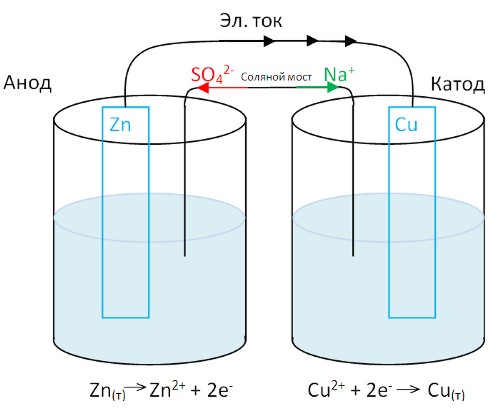
Медная пластинка (отрицательный электрод - анод) погружена в емкость с сульфатом меди.
Цинковая пластинка (положительный электрод - катод) - в раствор сульфата цинка.
Пластинки соединены между собой металлическим проводником. Но для того, чтобы в цепи появился электрический ток, необходимо соединить емкости соляным мостом (трубка, заполненная концентрированной соляным раствором). Соляной мост позволяет ионам перемещаться из одной емкости в другую, при этом растворы остаются электрически нейтральными. Что происходит с системой?
Цинк окисляется: атомы цинка превращаются в ионы и переходят в раствор. Высвободившиеся электроны движутся по внешней цепи к медному электроду, где происходит восстановление ионов меди. Приходящие сюда электроны соединяются с выходящими из раствора ионами меди. При этом образуются атомы меди, выделяющиеся в виде металла. Катионы соляного моста перемещаются в емкость с медным электродом для замещения расходуемых ионов меди. Анионы соляного моста перемещаются в емкость с цинковым электродом, помогая сохранять электрически нейтральный раствор с образующимися катионами цинка.
Разность потенциалов (напряжение) в такой системе будет тем больше, чем дальше металлы находятся друг от друга в ряду активности.
2. Сухой элемент
В бытовых электрических батарейках используется сухой элемент, состоящий из:
- цинкового корпуса (анод);
- находящегося внутри корпуса графитового стержня (катод).
Стержень окружен слоем оксида марганца и угольной сажи, в качестве электролита используется слой хлорида аммония и хлорида цинка. В результате этого происходят следующие реакции:
- реакция окисления: Zn(т) → Zn2+ + e-
- реакция восстановления: 2MnO2 (т) + 2NH4+ + 2e- → Mn2O3 (т) + 2NH3 (р-р) + H2O(ж)
В щелочном сухом элементе вместо кислой среды хлорида аммония в качестве электролита используется щелочная среда гидроксида калия, что повышает срок службы элемента, т.к., корпус не так быстро корродирует.
Основным недостатком гальванических элементов является тот факт, что производство электричества идет до тех пор, пока не закончится один из реагентов.
3. Аккумуляторы
Аккумуляторы устраняют главный недостаток сухих элементов - короткий срок службы, поскольку могут перезаряжаться, а потому, время их эксплуатации повышается во много раз и составляет несколько лет.
Обычный свинцовый аккумулятор состоит из шести, последовательно соединенных, элементов (банок). Каждая банка дает напряжение 2В, а их сумма = 12В.
В качестве анода используется свинец. Катод - диоксид свинца (PbO2). Электроды погружены в раствор серной кислоты (H2SO4). При замыкании цепи в аккумуляторе происходят следующие реакции:
На аноде: Pb(т) + H2SO4 (p-p) → PbSO4 (т) + 2H+ + 2e-
На катоде: 2e- +2H+ + PbO2(т) + H2SO4 (p-p) → PbSO4 (т) + 2H2O(ж)
Общая: Pb(т) + PbO2 (т) + 2H2SO4 (p-p) → 2PbSO4 (т) + 2H2O(ж)
Аккумулятор (при исправном состоянии автомобиля) служит только для пуска двигателя. В момент пуска в цепи протекает довольно значительный ток (десятки ампер), поэтому, заряд аккумулятора расходуется очень быстро (за несколько минут). После того, как двигатель запущен, всё электропитание автомобиля берет на себя генератор. Во время работы двигателя генератор подзаряжает аккумулятор: первоначальные окислительно-восстановительные реакции протекают в обратном направлении:
2PbSO4 (т) + 2H2O(ж) → Pb(т) + PbO2 (т) + 2H2SO4 (p-p)
В результате восстанавливается свинец и диоксид свинца.
4. Гальваническое покрытие
Суть электролитических элементов состоит в осуществлении за счет электроэнергии химических реакций - восстановления на катоде и окисления на аноде.
Окислительно-восстановительная реакция, протекающая на электродах при прохождении электротока через электролитический элемент, называется электролизом:
Электролиз воды: 2H2O(ж) → 2H2 (г) + O2 (г)
Электролитические элементы используются для получения гальванопокрытий. При этом один металл наносится тончайшим слоем на поверхность другого металла.
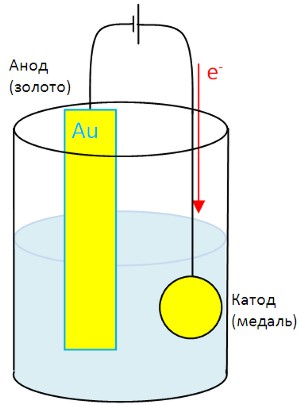
Источником электроэнергии при гальванопокрытии служит внешний источник тока. Брусок золота является источником ионов золота, которые восстанавливаются на поверхности медали.
Покрытия, нанесенные методом электролиза, получаются ровными по толщине и прочными. В итоге изделие внешне ничем не отличается от "чистого" варианта, а по цене - существенно дешевле.
