Периодическая таблица химических элементов Д.И.Менделеева
- Металлы, неметаллы, металлоиды
- Периоды и группы
- Щелочные металлы
- Щелочноземельные металлы
- Галогены
- Инертные (благородные) газы
- Валентные элементы в группах
В природе существует очень много повторяющихся последовательностей:
- времена года;
- время суток;
- дни недели…
В середине 19 века Д.И.Менделеев заметил, что химические свойства элементов также имеют определенную последовательность (говорят, что эта идея пришла ему во сне). Итогом чудесных сновидений ученого стала Периодическая таблица химических элементов, в которой Д.И. Менделеев выстроил химические элементы по возрастанию атомной массы. В современной таблице химические элементы выстроены по возрастанию атомного номера элемента (количество протонов в ядре атома).
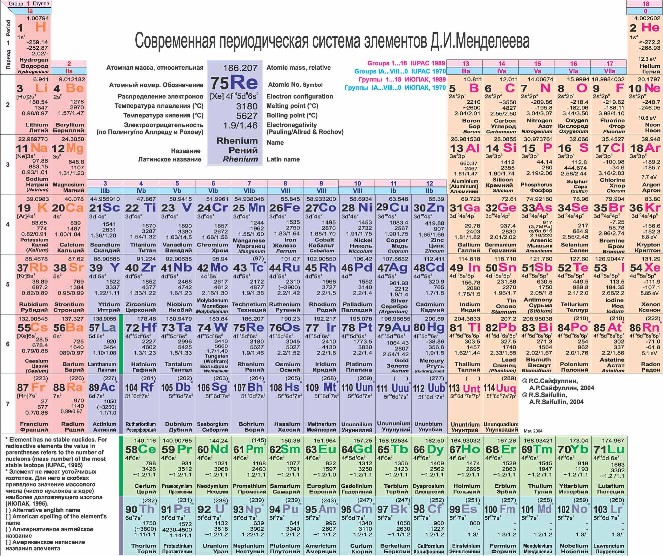
Смотреть таблицу в натуральную величину.
Атомный номер изображен над символом химического элемента, под символом - его атомная масса (сумма протонов и нейтронов). Обратите внимание, что атомная масса у некоторых элементов является нецелым числом! Помните об изотопах! Атомная масса - это средневзвешенное от всех изотопов элемента, встречающихся в природе в естественных условиях.

Под таблицей расположены лантаноиды и актиноиды.
|
Горизонтальные строки Периодической таблицы называют периодами. Периоды имеют номера от 1 до 7. |
|
Вертикальные столбцы Периодической таблицы называют группами (семействами). Для нумерации групп изначально применялись римские цифры и буквы (IA, IIA, IIIB…). Ныне для обозначения групп используют номера от 1 до 18. |
Металлы, неметаллы, металлоиды
Металлы
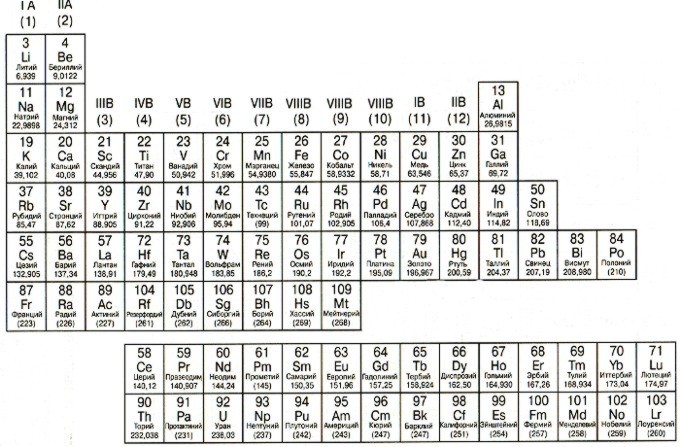
Металлы расположены в Периодической таблице слева от ступенчатой диагональной линии, которая начинается с Бора (В) и заканчивается полонием (Po) (исключение составляют германий (Ge) и сурьма (Sb). Нетрудно заметить, что металлы занимают бОльшую часть Периодической таблицы. Основные свойства металлов: твердые (кроме ртути); блестят; хорошие электро- и теплопроводники; пластичные; ковкие; легко отдают электроны.
Общая характеристика металлов...
Неметаллы
Элементы, расположенные справа от ступенчатой диагонали B-Po, называются неметаллами. Свойства неметаллов прямо противоположны свойствам металлов: плохие проводники тепла и электричества; хрупкие; нековкие; непластичные; обычно принимают электроны.
Общая характеристика неметаллов...
Металлоиды
Между металлами и неметаллами находятся полуметаллы (металлоиды). Для них характерны свойства как металлов, так и неметаллов. Основное применение в промышленности полуметаллы нашли в производстве полупроводников, без которых немыслима ни одна современная микросхема или микропроцессор.
Периоды и группы
Как уже говорилось выше, периодическая таблица состоит из семи периодов. В каждом периоде атомные номера элементов увеличиваются слева направо.
Свойства элементов в периодах изменяются последовательно: так натрий (Na) и магний (Mg), находящиеся в начале третьего периода, отдают электроны (Na отдает один электрон: 1s22s22p63s1; Mg отдает два электрона: 1s22s22p63s2). А вот хлор (Cl), расположенный в конце периода, принимает один элемент: 1s22s22p63s23p5.
| Свойства химических элементов в пределах одного периода различаются. |
В группах же, наоборот, все элементы обладают одинаковыми свойствами. Например, в группе IA(1) все элементы, начиная с лития (Li) и заканчивая францием (Fr), отдают один электрон. А все элементы группы VIIA(17), принимают один элемент.
Некоторые группы настолько важны, что получили особые названия. Эти группы рассмотрены ниже.
Щелочные металлы
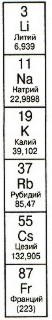
Группа IA(1). Атомы элементов этой группы имеют во внешнем электронном слое всего по одному электрону, поэтому легко отдают один электрон.
Наиболее важные щелочные металлы - натрий (Na) и калий (K), поскольку играют важную роль в процессе жизнедеятельности человека и входят в состав солей.
Электронные конфигурации:
- Li - 1s22s1;
- Na - 1s22s22p63s1;
- K - 1s22s22p63s23p64s1
Подробнее о щелочных металлах см. Атомы элементов I группы: общая характеристика...
Щелочноземельные металлы

Группа IIA(2). Атомы элементов этой группы имеют во внешнем электронном слое по два электрона, которые также отдают во время химических реакций. Наиболее важный элемент - кальций (Ca) - основа костей и зубов.
Электронные конфигурации:
- Be - 1s22s2;
- Mg - 1s22s22p63s2;
- Ca - 1s22s22p63s23p64s2
Подробнее о щелочноземельных металлах см. Атомы элементов II группы: общая характеристика...
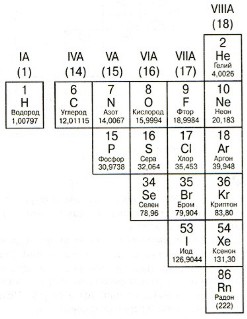
Галогены

Группа VIIA(17). Атомы элементов этой группы обычно получают по одному электрону, т.к. на внешнем электронном слое находится по пять элементов и до "полного комплекта" как раз не хватает одного электрона.
Наиболее известные элементы этой группы: хлор (Cl) - входит в состав соли и хлорной извести; йод (I) - элемент, играющий важную роль в деятельности щитовидной железы человека.
Электронная конфигурация:
- F - 1s22s22p5;
- Cl - 1s22s22p63s23p5;
- Br - 1s22s22p63s23p64s23d104p5
Подробнее о галогенах см. Атомы элементов VII группы: общая характеристика...
Инертные (благородные) газы

Группа VIII(18). Атомы элементов этой группы имеют полностью "укомплектованный" внешний электронный слой. Поэтому им "не надо" принимать электроны. И отдавать их они "не хотят". Отсюда - элементы этой группы очень "неохотно" вступают в химические реакции. Долгое время считалось, что они вообще не вступают в реакции (отсюда и название "инертный", т.е. "бездействующий"). Но химик Нейл Барлетт открыл, что некоторые из этих газов при определенных условиях все же могут вступать в реакции с другими элементами.
Электронные конфигурации:
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - 1s22s22p63s23p64s23d104p6
Подробнее об инертных (благородных) газах см. Атомы элементов 0 группы: общая характеристика...
Валентные элементы в группах
Нетрудно заметить, что внутри каждой группы элементы похожи друг на друга своими валентными электронами (электроны s и p-орбиталей, расположенных на внешнем энергетическом уровне).
У щелочных металлов - по 1 валентному электрону:
- Li - 1s22s1;
- Na - 1s22s22p63s1;
- K - 1s22s22p63s23p64s1
У щелочноземельных металлов - по 2 валентных электрона:
- Be - 1s22s2;
- Mg - 1s22s22p63s2;
- Ca - 1s22s22p63s23p64s2
У галогенов - по 7 валентных электронов:
- F - 1s22s22p5;
- Cl - 1s22s22p63s23p5;
- Br - 1s22s22p63s23p64s23d104p5
У инертных газов - по 8 валентных электронов:
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - 1s22s22p63s23p64s23d104p6
| Римский номер столбца группы - это количество валентных электронов у всех элементов данной группы. |
Дополнительную информацию см. в статье Валентность и в Таблице электронных конфигураций атомов химических элементов по периодам.
Обратим теперь свое внимание на элементы, расположенные в группах с символов В. Они расположены в центре периодической таблицы и называются переходными металлами.
Отличительной особенностью этих элементов является присутствие в атомах электронов, заполняющих d-орбитали:
- Sc - 1s22s22p63s23p64s23d1;
- Ti - 1s22s22p63s23p64s23d2
Отдельно от основной таблицы расположены лантаноиды и актиноиды - это, так называемые, внутренние переходные металлы. В атомах этих элементов электроны заполняют f-орбитали:
- Ce - 1s22s22p63s23p64s23d104p64d105s25p64f15d16s2;
- Th - 1s22s22p63s23p64s23d104p64d105s25p64f145d106s26p66d27s2
Подробнее см. Атомы переходных элементов (металлов)...
