Окислительно-восстановительные реакции для "чайников"
Все химические реакции делятся на два вида:
- реакции, в ходе которых не происходит изменения степени окисления атомов взаимодействующих веществ:
Na+1Cl-1+Ag+1N+5O3-2 = Ag+1Cl-1↑+Na+1N+5O3-2 - реакции, в ходе которых взаимодействующие вещества меняют свои степени окисления:
2K+1I-1+Cl20 = 2K+1Cl-1+I20
Второй тип реакций называют окислительно-восстановительными.
Нетрудно заметить, что в уравнении первой реакции степени окисления элементов в левой и правой частях уравнения одинаковы. Во втором уравнении хлор меняет свою степень окисления с 0 на -1, а йод, наоборот, с -1 на 0.
Возникает логичный вопрос, а почему, собственно, такие реакции получили название окислительно-восстановительных, а, не, скажем, окислительно-изменительных? И, вообще, что это за "зверь" такой окисление?
Для того, чтобы обстоятельно ответить на эти вопросы, предварительно следует разобрать такие понятия, как "валентность", "электроотрицательность" и "степень окисления".
Немного забегая вперед, можно сказать, что окисление и восстановление являются "парой сапог" - окисление всегда сопровождается восстановлением, а восстановление связано с окислением. Если проводить аналогию с повседневной жизнью, то это, как давать и брать в долг деньги - кредитор и заемщик не могут существовать отдельно друг от друга, как только один человек передал свои деньги в руки другого, он становится кредитором, а человек, взявший эти деньги - заемщиком. Так же и в химии - элемент, отдавший свои электроны другому элементу, тотчас же становится восстановителем, а элемент, получивший эти электроны - окислителем.
|
Окислительно-восстановительные реакции сопровождаются перемещением электронов от одних атомов (молекул, ионов) к другим |
Изложение дальнейшего материала ведется с учетом того, что читатель знаком с понятиями "атом" и "электрон". Вкратце лишь напомним, что атом элемента состоит из ядра (положительно заряженного) и электронов (отрицательно заряженных), которые вращаются по своим орбиталям вокруг ядра.
Что происходит, когда атом отдает свои электроны? Поскольку электроны являются отрицательно заряженными частицами, то, уменьшение их количества автоматически приводит к увеличению заряда атома.
Атом (молекула, ион), получивший электрон, наоборот, уменьшает свой заряд.
Опять же, если переводить все вышесказанное с языка химии на язык обывателя, то вещество-восстановитель является человеком-кредитором, а вещество-окислитель - человеком-заемщиком.
ВНИМАНИЕ! Теперь начнём "путать следы".
- Атом, отдающий электрон, называется восстановителем, а процесс отдачи электронов - окислением;
- Атом, принимающий электрон, называется окислителем, а процесс приема электронов - восстановлением.
В общем, надо признать, что такая терминология не лишена логики, ведь, если переложить язык химии на повседневную жизнь, то:
- Человек, отдающий деньги, называется кредитором, а сам процесс отдачи денег, называется заёмом.
- Человек, берущий деньги, называется заёмщиком, а сам процесс принятия денег, называется кредитом.
Продолжаем "путать следы" дальше.
- Атом-восстановитель, участвующий в процессе окисления, - окисляется;
- Атом-окислитель, участвующий в процессе восстановления, - восстанавливается.
Подводим краткий итог сказанному:
|
ОКИСЛЕНИЕ - процесс отдачи атомом электрона, при котором степень его окисления повышается Fe2+-e- = Fe3+; 2Cl--2e- = Cl20 |
|
ВОССТАНОВЛЕНИЕ - процесс приема атомом электрона, при котором степень его окисления понижается S0+2e- = S-2; Fe+3+e- = Fe+2 |
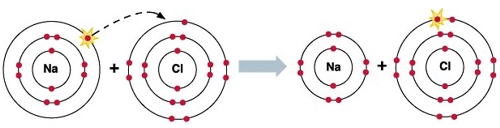
На рисунке выше показано взаимодействие атома натрия с атомом хлора, в ходе которого, натрий отдает один свой электрон атому хлора. В этой реакции натрий является элементом-восстановителем, в ходе реакции он окисляется (степень окисления натрия увеличивается); атом хлора является элементом-окислителем, в ходе реакции он восстанавливается (степень окисления хлора уменьшается).
Следует понимать, что в окислительно-восстановительных реакциях кол-во отдаваемых электронов веществом-восстановителем, обязательно равно кол-ву электронов, принятых веществом-окислителем. Если кредитор дал взаймы 100 долларов, то заемщик получил кредит в 100 долларов.
Электроны могут переходить от одного атома к другому как полностью, так и частично (подробнее об этом будет сказано позже), но при разборе окислительно-восстановительных реакций химики не обращают внимания на подобные нюансы, считая, что один атом электроны отдает, а другой - их принимает.
