Ионная связь
Химия - "волшебная" наука. А где вы еще получите безопасное вещество, соединив два опасных? Речь идет об обыкновенной поваренной соли - NaCl. Рассмотрим подробнее каждый элемент, опираясь на ранее полученные знания об устройстве атома.
Натрий - Na, щелочной металл (группа IA).
Электронная конфигурация: 1s22s22p63s1
Как видим, натрий имеет один валентный электрон, который он "согласен" отдать, чтобы его энергетические уровни стали завершенными.
Хлор - Cl, галоген (группа VIIA).
Электронная конфигурация: 1s22s22p63s23p5
Как видим, хлор имеет 7 валентных электронов и ему "не хватает" одного электрона, чтобы его энергетические уровни стали завершенными.
Теперь догадываетесь, почему так "дружны" атомы хлора и натрия?
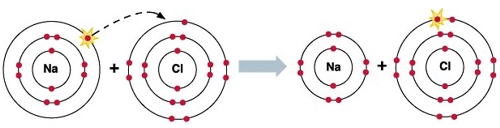
Ранее говорилось, что полностью "укомплектованные" энергетические уровни имеют инертные газы (группа VIIIA) - у них полностью заполнены внешние s и p-орбитали. Отсюда они так плохо вступают в химические реакции с другими элементами (им просто не надо ни с кем "дружить", поскольку ни отдавать, ни принимать электроны они "не хотят").
|
Главный закон химической реакции - заполнение валентного энергетического уровня |
Когда валентный энергетический уровень заполнен - элемент становится стабильным или насыщенным.
Инертным газам "повезло", а что же делать остальным элементам периодической таблицы? Конечно же, "искать" себе пару, подобно дверному замку и ключу - определенному замку соответствует свой ключ. Так и химические элементы, пытаясь заполнить свой внешний энергетический уровень, вступают с другими элементами в реакции, создавая устойчивые соединения. Т.к. заполняются внешние s (2 электрона) и р (6 электронов) орбитали, то данный процесс получил название "правило октета" (октет = 8)
| Любой атом может получить или отдать не более трех электронов |
Натрий: Na
На внешнем энергетическом уровне атома натрия находится один электрон. Для перехода в стабильное состояние, натрий должен: либо отдать этот электрон, либо принять семь новых. Исходя из вышесказанного, натрий будет отдавать электрон. При этом у него "исчезает" 3s-орбиталь, а количество протонов (11) будет на один превосходить количество электронов (10). Поэтому, нейтральный атом натрия превратится в положительно заряженный ион - катион.
Электронная конфигурация катиона натрия: Na+ 1s22s22p6
Особо внимательные читатели справедливо скажут, что такая же электронная конфигурация и у неона (Ne). Так что же, натрий превратился в неон? Вовсе нет - не забывайте о протонах! Их по-прежнему; у натрия - 11; у неона - 10. Говорят, что катион натрия является изоэлектронным неону (поскольку их электронные конфигурации одинаковы).
Подведем итог:
- атом натрия и его катион отличаются одним электроном;
- катион натрия имеет меньший размер, поскольку он теряет внешний энергетический уровень.
Хлор: Cl
У хлора ситуация прямо противоположная - на внешнем энергетическом уровне у него находится семь валентных электронов и ему надо принять один электрон, чтобы стать стабильным. При этом произойдут следующие процессы:
- атом хлора примет один электрон и станет отрицательно заряженным анионом (17 протонов и 18 электронов);
- электронная конфигурация хлора: Cl- 1s22s22p63s23p6
- анион хлора является изоэлектронным аргону (Ar);
- поскольку внешний энергетический уровень хлора "достроился", то радиус катиона хлора будет немного больше, чем у "чистого" атома хлора.
Поваренная соль (хлорид натрия): NaCl
Исходя из вышесказанного, видно, что электрон, который отдает натрий, становится электроном, который получает хлор.
В кристаллической решетке хлорида натрия каждый катион натрия окружен шестью анионами хлора. И наоборот, каждый анион хлора окружен шестью катионами натрия.
В результате перемещения электрона образуются ионы: катион натрия (Na+) и анион хлора (Cl-). Поскольку противоположные заряды притягиваются, то образуется устойчивое соединение NaCl (хлорид натрия) - поваренная соль.
В результате взаимного притяжения противоположно заряженных ионов, образуется ионная связь - устойчивое химическое соединение.
Соединения с ионными связями называют солями. В твердом состоянии все ионные соединения являются кристаллическими веществами.
|
Ионная связь - химическая связь между катионами и анионами (заряженными частицами, в которые превращаются атомы после отдачи или присоединения электронов). |
Следует понимать, что понятие ионной связи довольно относительно, строго говоря к "чистым" ионным соединениям можно отнести только те вещества, у которых разность в электроотрицателности атомов, которые образуют ионную связь, равна или более 3. По этой причине в природе существует всего с десяток чисто ионных соединений - это фториды щелочных и щелочно-земельных металлов (например, LiF; относительная электроотрицательность Li=1; F=4).
Чтобы не "обижать" ионные соединения, химики договорились считать, что химическая связь является ионной, если разность электроотрицательностей атомов, образующих молекулу вещества равна или более 2. (см. понятие электроотрицательности).
Катионы и анионы
Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что:
- элементы группы IA (щелочные металлы) отдают один электрон и образуют катион с зарядом 1+;
- элементы группы IIA (щелочноземельные металлы) отдают два электрона и образуют катион с зарядом 2+;
- элементы группы IIIA отдают три электрона и образуют катион с зарядом 3+;
- элементы группы VIIA (галогены) принимают один электрон и образуют анион с зарядом 1-;
- элементы группы VIA принимают два электрона и образуют анион с зарядом 2-;
- элементы группы VA принимают три электрона и образуют анион с зарядом 3-;
Распространенные одноатомные катионы
| Группа | Элемент | Ион | Обозначение |
| IA |
Литий Натрий Калий |
Катион лития Катион натрия Катион калия |
Li+ Na+ K+ |
| IIA |
Бериллий Магний Кальций Стронций Барий |
Катион бериллия Катион магния Катион кальция Катион стронция Катион бария |
Be2+ Mg2+ Ca2+ Sr2+ Ba2+ |
| IB | Серебро | Катион серебра | Ag+ |
| IIB | Цинк | Катион цинка | Zn2+ |
| IIIB | Алюминий | Катион алюминия | Al3+ |
Распространенные одноатомные анионы
| Группа | Элемент | Ион | Обозначение |
| VIIA |
Фтор Хлор Бром Йод |
Анион фтора Анион хлора Анион брома Анион йода |
F- Cl- Br- I- |
| VIA |
Кислород Сера |
Анион кислорода Анион серы |
O2- S2- |
| VA |
Азот Фосфор |
Аниона азота Анион фосфора |
N3- P3- |
Не все так просто с переходными металлами (группа В), которые могут отдавать разное количество электронов, образуя при этом по два (и более) катиона, имеющих разные заряды. Например:
- Cr2+ - ион двухвалентного хрома; хром (II)
- Mn3+ - ион трехвалентного марганца; марганец (III)
- Hg22+ - ион двухатомной двухвалентной ртути; ртуть (I)
- Pb4+ - ион четырехвалентного свинца; свинец (IV)
| Электрический заряд, который получает атом, называется степенью окисления |
Многие ионы переходных металлов могут иметь разную степень окисления.
Ионы не всегда бывают одноатомными, они могут состоять из группы атомов - многоатомные ионы. Например, ион двухатомной двухвалентной ртути Hg22+: два атома ртути связаны в один ион и имеют общий заряд 2+ (каждый катион имеет заряд 1+).
Примеры многоатомных ионов:
- SO42- - сульфат
- SO32- - сульфит
- NO3- - нитрат
- NO2- - нитрит
- NH4+ - аммоний
- PO43+ - фосфат
