Водородная связь
Химические связи образуются не только между атомами, но, также и между молекулами. Одним из таких видов связи является водородная связь, возникающая между молекулами, в состав которых входит водород и элемент с высокой электроотрицательностью, связанный с атомом водорода ковалентной полярной связью (общая электронная пара смещена к более электроотрицательному атому, а атом водорода становится частично положительно заряженным): HF; H2O; NH3; HCl; H2S и проч.
Понятие электроотрицательности (способности атомов в химических связях притягивать к себе электроны) впервые в практику ввел в 1932 году американский химик Л. Полинг. Химики чаще пользуются относительными значениями электроотрицательности, при этом абсолютные величины электроотрицательности, определенные различными методами, несколько отличны друг от друга. В общем по периодической таблице прослеживается четкая зависимость - электроотрицательность химических элементов в периодах увеличивается слева направо (по мере увеличения порядкового номера элемента), а в группах уменьшается сверху вниз.
Подробнее об электроотрицательности см. Электроотрицательность для "чайников".
Наибольшей электроотрицательностью обладают неметаллы:
F - 3,98; O - 3,44; Cl - 3,16; N - 3,04; Br - 2,96; I - 2,66; S - 2,58; C, Se - 2,55; H - 2,20.
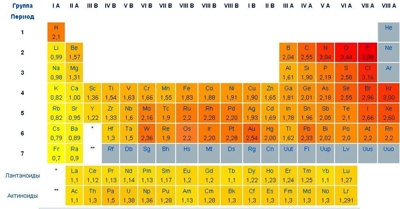
Таблица электроотрицательности химических элементов (см. таблицу в натуральную величину).
В водородной связи роль донора играет электроотрицательный элемент, обладающий частичным отрицательным зарядом и свободными электронными парами; роль акцептора отведена атому водорода.
Водородная связь не образуется в соединениях водорода с элементами, электроотрицательность которых близка к электроотрицательности водорода: CH4; PH3…
Проследим механизм образования водородной связи в молекуле воды. Поскольку ковалентная связь О - Н сильно полярная, то на атоме водорода образуется частичный положительный заряд, а на атоме кислорода - частично отрицательный, что приводит к сильному смещению электрона водорода, при этом его орбиталь оказывается практически свободной и с ней начинает взаимодействовать свободная электронная пара атома кислорода другой молекулы воды - это и есть водородная связь, при которой один из атомов водорода расположен между двумя электроотрицательными атомами кислорода, с одним из которых связывается ковалентной связью.
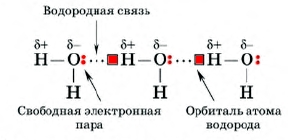
Благодаря водородным связям молекулы могут объединяться в ассоциаты.
Следует сказать, что сила водородной связи примерно на порядок меньше ковалентной (для ее разрыва достаточно 10-100 кДж/моль энергии). Однако, несмотря на это, водородные связи оказывают существенное влияние на такие физико-химические свойства соединений, как температура кипения, плавления, растворимость в воде. Например, вещества с водородной связью (вода, низкомолекулярные спирты, аммиак и проч.) имеют достаточно высокие температуры кипения, поскольку для разрыва множественных водородных связей требуется дополнительная энергия.
Вещества, способные образовывать водородные связи с молекулами растворителя, обладают хорошей растворимостью. Также водородные связи достаточно широко распространены в природе, часто встречаются в белковых соединениях и нуклеиновых кислотах. В процессе обмена веществ в организме также образуются и расщепляются водородные связи.
