Формулы ковалентных связей
Формулы для ковалентных связей в корне отличаются от формул для ионных связей. Дело в том, что ковалентные соединения могут образовываться самыми разными способами, поэтому в результате реакции возможно появление различных соединений.
1. Эмпирическая формула
В эмпирической формуле указываются элементы, из которых состоит молекула, с наименьшим целочисленными соотношениями.
Например, C2H6O - соединение содержит два атома углерода, шесть атомов водорода и один атом кислорода.
2. Молекулярная формула
Молекулярная формула указывает из каких атомов состоит соединение и в каких количествах эти атомы в нем находятся.
Например, для соединения C2H6O молекулярными формулами могут быть: C4H12O2; C6H18O3...
Для полного описания ковалентного соединения молекулярной формулы недостаточно:
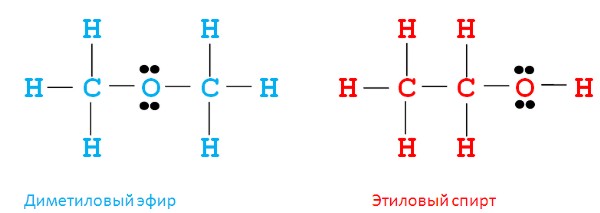
Как видим, оба соединения имеют одинаковую молекулярную формулу - C2H6O, но являются совершенно разными веществами:
- диметиловый эфир применяется в холодильных установках;
- этиловый спирт - основа алкогольных напитков.
| Соединения, обладающие одним и тем же качественным и количественным составом, но разными свойствами, называются изомерами |
3. Структурная формула
Структурная формула служит для точного определения ковалентного соединения, т.к., кроме элементов в соединении и количества атомов, показывает еще и схему связей соединения.
В качестве структурной формулы используют электронно-точечную формулу и формулу Льюиса.
4. Структурная формула для воды (H2O)
Рассмотрим порядок построение структурной формулы на примере молекулы воды.
I Строим каркас соединения
Атомы соединения располагаются вокруг центрального атома. В качестве центральных обычно выступают атомы: углерода, кремния, азота, фосфора, кислорода, серы.
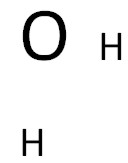
II Находим сумму валентных электронов всех атомов соединения
Для воды: H2O = (2·1 + 6) = 8
В атоме водорода один валентный электрон, в атоме кислорода - 6. Поскольку в соединении присутствует два атома водорода, то общее число валентных электронов молекулы воды будет равно 8.
III Определяем количество ковалентных связей в молекуле воды
Определяем по формуле: S = N - A, где
S - количество электронов, совместно используемых в молекуле;
N - сумма валентных электронов, соответствующих завершенному внешнему энергетическому уровню атомов в соединении:
N = 2 - для атома водорода;
N = 8 - для атомов остальных элементов
A - сумма валентных электронов всех атомов в соединении.
Для H20
N = 2·2 + 8 = 12
A = 2·1 +6 = 8
S = 12 - 8 = 4
В молекуле воды совместно используемых электронов - 4. Поскольку ковалентная связь состоит из пары электронов, то получаем две ковалентные связи.
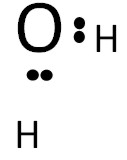
IV Распределяем совместные электроны
Между центральным атомом и атомами, которые окружают его, должна быть хотя бы одна связь. Для молекулы воды таких связей будет по два для каждого атома водорода:
V Распределяем оставшиеся электроны
Из восьми валентных электронов четыре уже распределены. Куда "девать" оставшиеся четыре электрона?
Каждый атом в соединении должен иметь полный октет электронов. Для водорода - это два электрона; для кислорода - 8.
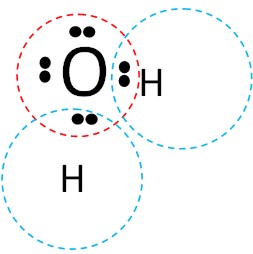
Совместно используемые электроны называются связывающими.
Формула Льюиса для молекулы воды:
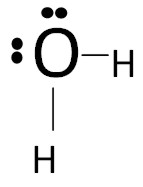
Электронно-точечная формула и формула Льюиса наглядно описывают строение ковалентной связи, но громоздки и занимают много места. Этих недостатков можно избежать применяя сжатую структурную формулу, в которой указывается только порядок "следования" связей.
Пример сжатой структурной формулы:
- диметиловый эфир - CH3OCH3
- этиловый спирт - C2H5OH
