Написание формулы по валентности
Валентность - способность атома присоединять то или иное число других атомов с образованием химической связи (см. "Что такое валентность").
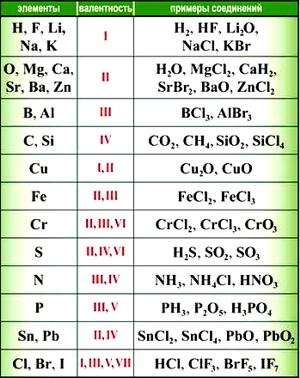
Для того, чтобы выводить химические формулы веществ по валентности элементов, необходимо знать, как минимум, валентности наиболее часто встречающихся элементов.
Алгоритм написания химической формулы вещества по валентности элементов, входящих в него:
- записать химические знаки элементов, входящих в вещество;
- определить валентность этих элементов;
- найти наименьшее общее кратное для валентностей этих элементов;
- определить индексы для атомов.
Составление формулы оксидов по валентности элементов
В качестве примера составим формулу оксида железа (III).
- В оксид железа входят железо и кислород: Fe O;
- Указываем валентность этих элементов: FeIII OII;
- Находим наименьшее общее кратное (НОК): 3·2=6;
- Делим НОК на число единиц валентности каждого элемента:
- для Fe - 6:3=2;
- для O - 6:2=3.
- Записываем полученные индексы справа внизу от элемента: Fe2O3.
Составление формулы оснований
Важный нюанс, который неободимо знать - группы атомов могут рассматриваться, как единое целое.
Составление формул оснований по валентности элементов отличается от составления формулы оксидов лишь тем, что вместо атома кислорода в формуле стоит гидроксогруппа OH. В случае, если гидроксогруппа в формуле повторяется несколько раз, она берется в скобки.
В качестве примера составим составим формулу гидроксида магния.
На первом месте в основаниях стоит атом металла, гидроксогруппа - на втором.
- Mg OH
- MgII OHI
- НОК = 2·1 = 2
- для Mg: 2:2=1; OH: 2:1=2
- Ca(OH)2
Составление формулы солей
В солях "роль" гидроксогруппы OH играют кислотные остатки.
На первом месте в формуле средней соли стоит атом(ы) металла, кислотный остаток - на втором.
В качестве примера составим формулу соли фосфата натрия.
- Na PO4
- NaI PO4III
- НОК = 3·1 = 3
- для Na: 3:3=1; PO4: 3:1=3
- Na3PO4
Составление формулы кислот
На первом месте в формуле кислот стоит атом(ы) водорода, кислотный остаток - на втором.
В качестве примера составим формулу серной кислоты.
- H SO4
- HI SO4II
- НОК = 2·1 = 2
- для H: 2:1=2; SO4: 2:2=1
- H2SO4
Потренируемся в решении обратной задачи, когда по готовой формуле надо определить валентность элементов.
Определение валентности по готовой формуле
"Фишка" решения подобных задач заключается в том, что некоторые химические элементы в любых соединениях, в которые они входят, имеют постоянную валентность.
Элементы с постоянной валентностью:
- валентность I: H, F, Li, Na, K, Rb, Cs
- валентность II: O, Mg, Ca, Sr, Ba, Zn
- валентность III: Al
Большинство элементов в различных соединениях могут принимать различную валентность,, т. е., образовывать различное число химических связей.
Для нахождения валентности элементов с переменной валентностью в том или ином соединении используют правило валентности.
| x·m=y·n |
| в бинарных соединениях типа AmBn произведение валнетности элемента A(x) на кол-во его атомов m равно произведению валентности элемента B(y) на число его атомов n |
Определим, используя правило валентности, валентность фософра в соединении P2O5.
Поскольку валентность кислорода равна II, то:
P2xO5II x·2=2·5 x=5 P2VO5II
Теперь решим ту же задачу, используя алгоритм, описанный выше для выведения формулы по валентности, который будем применять "сзади-наперёд".
Определим валентность фосфора и кислорода в соединении P2O5.
- P2O5
- валентность кислорода равна двум: P2O5II
- общее число единиц валентности всех атомов вещества будет равно 2·5=10
- делим общее число единиц валентности (10) на индекс кислорода, валентность которого известна: 10:2=5 - это и будет валентность неизвестного, в нашем случае, фосфора
- P2VO5II
Немного усложним задачу и определим валентность элементов в соли кислородсодержащей кислоты Al2(SO4)3.
- решение задачи начинается с элемента с известной валентностью, т. е., с кислорода - определяем кол-во его атомов: 4·3=12
- с учётом того, что валентность кислорода равна 2, находим общее число единиц валентности для кислорода: 12·2=24
- по аналогии вычисляем общее число единиц валентности для атомов алюминия (валентность=3): 2·3=6
- от общего числа единиц валентности кислорода вычитаем общее число единиц валентности алюминия: 24-6=18 - это общее число единиц валентности, которое будет приходиться на серу
- по аналогии с кислородом определяем число атомов серы, валентность которой неизвестна: 1·3=3
- чтобы узнать валентность серы следует разделить разность, найденную в п.4, на число атомов серы: 18:3=6
- Al2III(SVIO4II)3
