Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак "плюс" перед числом обозначает выделившееся кол-во энергии, знак "минус" - кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии - эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1. Определить теплоту реакции горения 320 г серы.
S+O2=SO2+297 кДж
Решение задачи:
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
1 моль серы - 297 кДж 320 г серы - x кДж
- Переходим от молей к граммам:
M(S)=32 г/моль; m(S)=32 г
- В пропорции заменяем моли на граммы:
32 г серы - 297 кДж 320 г серы - x кДж x=2970 кДж
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2. Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
C+O2=CO2+402,24 кДж
Решение задачи:
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
при сгорании 12 г С выделилсь 402,24 кДж при сгорании x г - 33520 кДж x=12·33520/402,24=1000 г
Пример 3. При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
CH4+2O2=CO2+2H2O
Решение задачи:
1 л CH4 - 39 кДж 1 моль(22,4л) - x кДж x=22,4·39=874 кДж CH4+2O2=CO2+2H2O + 874 кДж
Пример 4. При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
2Mg+O2=2MgO+Q
Решение задачи:
2,4 г Mg - 60,12 кДж 2 моль(48 г) - x кДж x=48·60,12/2,4 = 1127,25 кДж 2Mg+O2=2MgO+Q + 1127,25 кДж
Пример 5. Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Решение задачи:
Это очень простая задача, решение которой указано в условии.
N2(г)+3H2(г) = 2NH3(г)+92кДж
Второй вариант записи термохимического уравнения.
N2(г)+3H2(г) = 2NH3(г); ΔH°=-92 кДж
Пример 6. Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Решение задачи:
Первая часть задания не вызывает трудностей:
N2(г)+O2(г) = 2NO(г)-180 кДж
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
½N2(г)+½O2(г) = NO(г)90 кДж
Пример 7. При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
CaO+CO2 = CaCO3
Решение задачи:
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
при образовании 50 г CaCO3 выделилось 80 кДж при образовании 100 г CaCO3 выделилось x кДж x=160 кДж
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
CaO+CO2 = CaCO3+160 кДж
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
CaCO3 = CaO+CO2-160 кДж
- Q=-160 кДж
Пример 8. Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
1/2N2(г)+3/2H2(г) ↔ NH3(г)+46 кДж
Решение задачи:
- Согласно термохимического уравнения - 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
при образовании 1 моль (22,4 л) NH3 выделяется 46 кДж при образовании 2л NH3 выделяется x кДж x = 46·2/22,4 x = 4,1 кДж
Пример 9. Рассчитать тепловой эффект реакции:
4NH3(г)+3O2(г) = 2N2(г)+6H2O(ж)
Решение задачи:
- На основании первого следствия из закона Гесса:
ΔH°=(2ΔH°обр.N2+6ΔH°обр.H2O)-(4ΔH°обр.NH3+bΔH°обр.O2)
- Теплоты образования простых веществ равны нулю:
H°обр.N2=0 H°обр.O2=0
- Теплоты образования сложных веществ берем из таблицы:
H°обр.NH3=-46 кДж H°обр.H2O=-286 кДж
- Подставляем числовые значения в уравнение:
H°=6(-286)-4(-46)=-1532 кДж
- Термохимическое уравнение реакции будет иметь вид:
4NH3(г)+3O2(г) = 2N2(г)+6H2O(ж)+1532 кДж
Пример 10. Рассчитать тепловой эффект реакции:
C2H4(г)+H2(г)=C2H6(г) по термохимическим уравнениям: C2H4(г)+3O2(г)=2CO2(г)+2H2O(ж)+1410 кДж C2H6(г)+7/2O2(г)=2CO2()+3H2O(ж)+1560 кДж
Решение задачи:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
ΔH°=(ΔH°сгор.C2H4+ΔH°сгор.H2)-ΔH°сгор.C2H6
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
H2(г)+½O2(г)=H2O(ж)+286 кДж
- Подставляем численные значения в формулу:
ΔH°=-1410-286+1560=-136 кДж
- Термохимическое уравнение реакции будет иметь вид:
C2H4(г)+H2(г)=C2H6(г)+136 кДж
Пример 11. Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
N2(г)+3H2(г)=2NH3(г)
Решение задачи:
а)
- Записываем кинетическое уравнение данной реакции:
v=k·[N2]·[H2]3
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
v2=k·(2·[N2])·(2·[H2])3
- Составляем отношение и решаем его:
v2/v = (k·(2·[N2])·(2·[H2])3)/(k·2·[N2]·2·[H2]3) v2/v = 2·(2)3/1 = 16/1 = 16
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
б)
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
v=k·[N2]·[H2]3
- Для удобства чтения формул сделаем подстановку:
v=k·x·y3 x=[N2] y=[H2]3
- Кинетическое уравнение при снижении давления в 2 раза:
v2=k·x/2·(y/2)3 x=[N2] y=[H2]3
- Соотошение:
v2/v = (k·x/2·(y/2)3)/(k·x·y3) v2/v = (1/2·(1/2)3)/1 = 1/16
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12. Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Решение задачи:
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
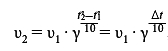
Все, что нам нужно сделать - подставить численные значения в формулу и провести расчеты:
t=10°C t2=30°C Δt=t2-t=20°C v-скорость реакции при t=10°C v2-скорость реакции при t=30°C v2=v·γ(Δt/10)=v·4(20/10)=v·16 v2/v = 16
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
