Электролитическая диссоциация: решение задач
Теоретический материал приведен на страницах:
- Что такое электролитическая диссоциация
- Степень диссоциации
- Диссоциация кислот и оснований
- Диссоциация воды
- Гидролиз солей
- Как составлять уравнения ионных реакций
Освежим в памяти основные моменты, которые необходимы при решении задач.
Степень диссоциации (α) - отношение кол-ва молекул, которые распались на ионы (N'), к общему кол-ву растворенных молекул (N):
| α = N'/N |
- α=0 - диссоциация отсутствует;
- α=0-3% - слабые электролиты - слабые кислоты (H2SO3, H2S, H2SiO3), слабые основания;
- α=3%-30% - средние электролиты;
- α=30%-100% - сильные электролиты - соли, сильные кислоты (HCl, HBr, HNO3, H2SO4(разб.)), некоторые основания (LiOH, KOH, NaOH);
- α=100% - полная диссоциация.
Степень диссоциации зависит от концентрации раствора.
Константа диссоциации электролита (K) - количественная характеристика диссоциации - отношение произведений концентрации ионов, образованных при диссоциации, к концентрации исходных частиц. Для электролита АВ, который диссоциирует по уравнению АВ↔A-+B+:
| K = ([A-][B+]):[AB] |
Константра диссоциации не зависит от концентрации веществ и может колебаться в очень ширком диапазоне - от 10-16 до 1015.
Степень и константа диссоциации связаны между собой соотношением, называемым Законом разведения Оствальда:
| K = ([A-][B+]):[AB] = C(α2:(1-α)) |
Для слабых электролитов:
| K ≈ α2C α ≈ √(K/C) |
Диссоциация воды и её константа диссоциации:
| H2O ↔ H++OH- K = ([OH-][H+]):[H2O] |
Поскольку вода является очень слабым электролитом, то концентрация [H2O] является практически неизменной, поэтому, остаётся постоянной и константа диссоциации воды (ионное произведение воды):
| Kω = [OH-][H+] = 10-14(при 25°C) |
Для чистой воды:
| [OH-]=[H+] = √10-14 = 10-7 моль/л |
На практике пользуются водородным показателем pH=-lg[H+]:
- pH=7 - нейтральная среда;
- pH<7 - кислая среда;
- pH>7 - щелочная среда.
Диссоциация кислот и оснований
Константа диссоциации одноосновных кислот (Ka-кислотный тип диссоциации; А--кислотный остаток):
| Kа = ([А-][H+]):[HА] |
Многоосновные кислоты диссоциируют в несколько стадий, у каждой из которых своя константа диссоциации.
Константа диссоциации оснований обозначается Kb.
Диссоциация малорастворимых веществ
Константа диссоциации малорастворимых веществ называется произведением растворимости (ПР).
|
AgClтв=Ag++Cl- K = ([Аg+][Cl-]):[AgClтв] ПР(AgCl) = [Аg+][Cl-] = const |
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
Взаимодействие солей с водой с образованием кислой и основной соли называется гидролизом.
Примеры решения задач
Пример 1. Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода (H+) с гидроксид-ионом (OH-).
Решение:
- ион водорода реагирует с гидроксид-ионом с образованием молекулы воды (реакция нейтрализации):
H++OH- = H2O
- ионы водорода образуются при диссоциации сильных кислот (HCl);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
HCl+NaOH = NaCl+H2O
Пример 2. Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона водорода с карбонат-ионом.
Решение:
- карбонат-ионы реагируют с ионами водорода с образованием гидрокарбонат-ионов (реакция протекает при недостатке ионов водорода):
H++CO32- = HCO3-
- второй вариант данной реакции - образование неустойчивой угольной кислоты, распадающейся на воду и оксид углерода (протекает при избытке ионов водорода):
2H++CO32- = H2CO3 → H2O+CO2↑
- Молекулярные уравнения реакций:
HCl+Na2CO3 = NaHCO3+NaCl 2HCl+Na2CO3 = 2NaCl+CO2↑+H2O
Пример 3. Написать молекулярное уравнение, соответствующее ионному уравнению взаимодействия иона серебра с гидроксид-ионом.
Решение:
- ион серебра реагирует с гидроксид-ионом с образованием неустойчивого соединения гидроксида серебра, распадающегося на воду и оксид серебра:
2Ag++2OH-=H2O+Ag2O↓
- ионы серебра образуются при диссоциации растворимых солей серебра (AgNO3);
- гидроксид-ионы образуются при диссоциации сильных оснований (NaOH);
2AgNO3+2NaOH=H2O+Ag2O↓+2NaNO3
Пример 4. При взаимодействии каких растворов получится карбонат кальция (CaCO3)?
Решение:
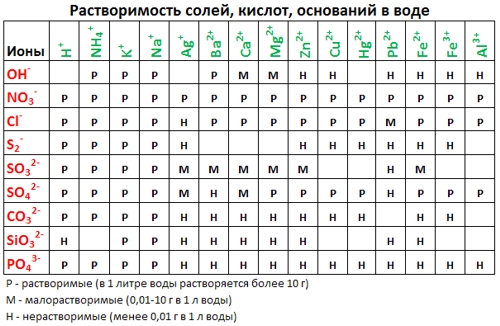
Из таблицы растворимости видно, что карбонат кальция нерастворим в воде.
- Сокращенное ионное уравнение для получения CaCO3 будет иметь следующий вид:
Ca2++CO32- = CaCO3↓
- Для решения задачи подойдет любое растворимое соединение кальция, которое будет диссоциировать с образованием ионов Ca2+, например, хлорид или нитрат кальция - CaCl2 или Ca(NO3)2;
- В качестве донора ионов CO32- сойдет любой растворимый в воде карбонат, например, Na2CO3 или K2CO3;
- Один из вариантов молекулярного уравнения:
CaCl2+Na2CO3 = CaCO3↓+2NaCl
Пример 5. Растворы каких солей нужны для получения:
- карбоната бария BaCO3;
- фосфата кальция (V) Ca3(PO4)2;
- сульфата свинца PbSO4
Решение:
- BaCO3
Ba2++CO32- → BaCO3↓ BaCl2+K2CO3=BaCO3↓+2KCl
- Ca3(PO4)2
3Ca2++2PO42- → Ca3(PO4)2↓ 3CaCl2+2Na3PO4=6NaCl+Ca3(PO4)2↓
- PbSO4
Pb2++SO42- → PbSO4↓ Pb(NO3)2+K2SO4 = PbSO4↓+2KNO3
Пример 6. Какие вещества образуются при взаимодействии растворов сульфата натрия (Na2SO4) и хлорида бария (BaCl2)?
Решение:
- Из таблицы растворимости видно, что обе соли растворимы в воде:
Ba2++2Cl- → BaCl2 2Na2++SO42- → Na2SO4
- При слиянии растворов образуются катионы натрия и бария и анионы хлора и оксида серы. Из таблицы растворимости видно, что нерастворимую в воде соль даст сочетание Ba2+ и SO42-:
Ba2++SO42-=BaSO4↓
- Уравнение реакции будет иметь вид:
Na2SO4+BaCl2=BaSO4↓+2NaCl
Пример 7. Какая соль выпадет в осадок при взаимодействии нитрата серебра (AgNO3) и хлорида кальция (CaCl2)? Написать уравнение реакции.
Решение:
2AgNO3+CaCl2 = 2AgCl↓+Ca(NO3)2 2Ag++2NO3-+Ca2++2Cl- = 2AgCl↓+2NO3-+Ca2+ 2Ag++2Cl- = 2AgCl↓ Ag++Cl- = AgCl↓ - хлорид серебра
Пример 8. Каким образом можно очистить поваренную соль (NaCl) от сульфата натрия (Na2SO4)?
Решение:
Идея решения задачи заключается в добавлении в раствор поваренной соли и сульфата натрия вещества, способного распадаться на ионы, которые свяжут ионы оксида серы в нерастворимую соль, высвободив тем самым ионы натрия.
Роль связывающего вещества выполнит хлорид кальция CaCl2.
Na2SO4+2NaCl+CaCl2 = CaSO4↓+4NaCl 2Na++SO42-+2Na++2Cl-+Ca2++2Cl-=CaSO4↓+4Na++4Cl- SO42-+Ca2+=CaSO4↓
После того, как CaSO4↓ выпадет в осадок, полученный раствор необходимо будет отфильтровать, после чего в фильтрате будет присутствовать чистая поваренная соль.
Пример 9. Написать молекулярное и ионное уравнение реакции хлорида алюминия с нитратом серебра.
Решение:
- Молекулярное уравнение:
AlCl3+3AgNO3 = 3AgCl↓+Al(NO3)3
- Полное ионное уравнение:
Al3++3Cl-+3Ag++3NO3- = 3AgCl↓+Al3++3NO3-
- Сокращенное ионное уравнение:
3Ag++3Cl- = 3AgCl↓ Ag++Cl- = AgCl↓
Пример 10. Рассчитать концентрацию ионов, образующихся при смешении 1 литра 0,25М раствора BaCl2 и 1 литра 0,5М раствора Na2SO4, после выпадения BaSO4 в осадок.
Решение:
- Молекулярное уравнение реакции:
BaCl2+Na2SO4 = BaSO4↓+2NaCl
- Сокращенное ионное уравнение:
Ba2++SO42- = BaSO4↓
- Рассчитаем исходные кол-ва ионов:
ν(Ba2+)=cV=0,25 моль ν(Cl-)=ν(Ba2+)=0,5 моль ν(SO42-)=0,5 моль ν(Na+)=2ν(SO42-)=1 моль
- (Ba2+) в обменной реакции присутствует в недостатке, поэтому, в реакцию вступает не 0,5, а только 0,25 SO42-;
- Объем полученного раствора 1+1=2 литра;
- Рассчитаем молярные концентрации ионов:
c(Cl-)=ν/V=0,5/2=0,25 моль/л c(SO42-)=(0,5-0,25)/2=0,125 моль/л c(Na+)=1/2=0,5 моль/л
Пример 11. Рассчитать pH водного раствора 0,1М HCl; 0,1M NaOH.
Решение:
- HCl - сильная кислота, диссоциирует полностью, уравнение диссоциации:
HCl → H++Cl- [H+]=0,1 моль/л pH = -lg(10-1) = -(-1) = 1
- NaOH - сильное основание, диссоциирует полностью, уравнение диссоциации:
NaOH → Na++OH- [OH-]=0,1 моль/л [H+]=Kω/[OH-]=10-14/0,1=10-13 pH = -lg(10-13) = -(-13) = 13
Пример 12. Рассчитать концентрацию ионов водорода в растворе аммиака с концентрацией 1,5 моль/л (K=1,7·10-5).
Решение:
- Формула равновесия, установленного в водном растворе аммиака:
NH3+H2O ↔ NH4++OH- K = [NH4+][OH-]/[NH3]=1,7·10-5
- Обозначим через x равновесную концентрацию [OH-]; тогда [NH4+]=x; [NH3]=1,5-x:
K = x·x/(1,5-x)=x2/(1,5-x)=1,7·10-5 x = 5·10-3 [H+]=Kω/[OH-] = 10-14/(5·10-3) = 2·10-12моль/л
Пример 13. Какое кол-во осадка образуется при смешении 250 мл растворов нитрита лития (концентрация 0,3 моль/л) и фторида натрия (0,2 моль/л), если произведение растворимости фторида лития ПР(LiF)=1,5·10-3.
Решение:
- Уравнение реакции:
Li++F-=LiF↓
- Рассчитаем исходные кол-ва ионов:
ν(Li+)=cV=0,3·0,25=0,075 моль/л ν(F-)=cV=0,2·0,25=0,05 моль/л
- Объем раствора равен 0,25+0,25=0,5 л
- Если обозначить через x моль кол-во выпавшего осадка LiF, тогда произведение концентрации ионов в растворе будет равно:
ПР=[Li+][F-] ПР=[(0,05-x)/0,5][(0,075-x)/0,5]=1,5·10-3 x=0,039
- Масса выпавшего осадка:
m(LiF)=0,039·26=1,014≈1 г
