Скорость химических реакций
Знание скоростей химический реакций имеет большое теоретическое и практическое значение. Например, в химической промышленности при производстве вещества от скорости реакции зависят размеры и производительность аппаратуры, количество получаемого продукта.
У разных химических реакций разная скорость. Некоторые реакции протекают в течение долей секунды, для осуществления других нужны месяцы, а то и годы. Скорость протекания химических реакций изучает химическая кинетика.
Основные понятия, с которыми оперирует химическая кинетика - это химическая система и фаза:
- Химическая система - вещество (совокупность веществ);
- Химическая фаза - часть системы, отделенная от других частей поверхностью раздела.
Системы, состоящие из одной фазы, называются однородными или гомогенными, например, газовые смеси или растворы. Реакции, протекающие в гомогенных системах, называются гомогенными реакциями, такие реакции протекают во всем объеме смеси.
Системы, состоящие из нескольких фаз, называютя неоднородными или гетерогенными, например, жидкость+твердое вещество. Реакции, протекающие в гетерогенных системах, называются гетерогенными реакциями, такие реакции протекают толькло на поверхности раздела фаз.
Скорость гомогенной реакции
| vгом = (ν2-ν1):(V(t2-t1)) = Δn:(V·Δt) |
Скоростью гомогенной реакции называют кол-во вещества (ν), образующегося в результате реакции за единицу времени (t) в единице объема системы (V):
- ν1 - кол-во молей вещества в момент времени t1;
- ν2 - кол-во молей вещества в момент времени t2;
Мольно-объемная концентрация вещества (С, моль/л) - отношение кол-ва молей вещества (ν) ко всему объему реакционной смеси (V): С=ν/V.
| vгом= ±ΔC:(t2-t1) = ±(C2-C1):Δt, моль/(л·с) |
Скорость гомогенной реакции равна изменению концентрации реагирующего вещества в единицу времени.
В том случае, если речь идет о концентрации одного из продуктов реакции, в выражении ставится знак "плюс", если о концентрации одного из искодных веществ - знак "минус".
Скорость гетерогенной реакции
| vгет = ±Δν:(S·Δt) |
Как уже было сказано выше, главное отличие гетерогенных реакций от гомогенных заключается в том, что реакция происходит на границе раздела фаз.
Скоростью гетерогенной реакции (vгет) называется кол-во вещества (ν), образующегося за единицу времени (t) на единице поверхности раздела фаз (S).
Основные факторы, влияющие на скорость реакций:
- природа реагирующих веществ;
- концентрация;
- температура;
- катализаторы;
- размеры частиц реагентов;
- давление.
Последние два пункта относятся к гетерогенным реакциям.
Природа реагирующих веществ
Необходимым условием химического взаимодействия между молекулами веществ является их столкновение друг с другом на "нужном" участке молекулы, называемом участком с высокой реакционной активностью. Это как в боксе: если удар боксера приходится в перчатки соперника, то реакции не будет; а вот если удар приходится в голову соперника, то вероятность нокаута (реакции) значительно возрастает; а если при этом сила удара (сила соударений молекул) велика, то нокаут (реакция) становится неизбежным.
Исходя из вышесказанного, можно сделать вывод, чем сложнее молекула, тем ее высокореактивный участок меньше. Отсюда, чем больше и сложнее молекулы реагирующих веществ, тем меньше скорость реакции.
Концентрация реагентов
Скорость реакции прямо пропорциональна числу соударений молекул. Чем выше концентрация реагентов, тем больше соударений, тем выше скорость химической реакции. Например, горение в чистом кислороде происходит гораздо быстрее, чем на обыкновенном воздухе.
Однако, следует сказать, что в сложных реакциях, протекающие в несколько стадий; такая зависимость не соблюдается. Это позволяет определить какой из реагентов не задействован в самой медленной стадии реакции, которая и определяет саму скорость реакции.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс, который был открыт в 1867 г. норвежскими учеными Гульдбергом и Вааге.
| Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ |
Скорость (v) условной реакции, описываемой уравнением aA+bB=cC+dD, в соответствии с законом действующих масс, будет вычисляться по формуле, которая носит название кинетического уравнения реакции:
v=k·[A]a·[B]b
- [A], [B] - концентрации исходных веществ;
- k - константа скорости реакции, равная скорости данной реакции при концентрациях реагирующих веществ, равной 1 моль каждая.
k не зависит от концентрации реагирующих веществ, но зависит от их природы и температуры.
По кинетическому уравнению реакции можно определить скорость изменения реакции в зависимости от изменения концентрации реагирующих веществ.
Примеры кинетических уравнений:
2SO2(г)+O2(г)=2SO3(г) v=k·[SO2]2·[O2] CuO(т)+H2(г)=Cu(т)+H2O(г) v=k·[H2]
Обратите внимание, что в кинетические уравнения не входят концентрации твердых веществ, а только газообразных и растворенных.
Температура реагентов
При повышении температуры молекулы движутся быстрее, отсюда возрастает количество их соударений друг с другом. Кроме этого, увеличивается кинетическая энергия молекул, что повышает эффективность соударений, которые в конечном счете и определяют скорость реакции.
Согласно теории активации, в химической реакции могут принять участие лишь молекулы, обладающие энергией, которая превышает некую среднюю величину. Величина превышения средней энергии молекул носит название энергии активации. Эта энергия необходима для ослабления химических связей в молекулах исходных веществ. Молекулы, обладающие необходимой избыточной энергией, что позволяет им вступать в реакцию, называются активными молекулами. Чем выше температура, тем больше активных молекул, тем выше скорость реакции.
Зависимость скорости реакции от температуры характеризуется правилом Вант-Гоффа:
| При повышении температуры на 10°C скорость большинства реакций возрастает в 2-4 раза |
Математически правило Вант-Гоффа выражается следующей формулой:
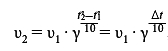
- γ - температурный коэффициент, показывающий увеличение скорости реакции при повышении температуры на 10°C;
- v1 - скорость реакции при температуре t1;
- v2 - скорость реакции при температуре t2;
Катализаторы
Катализаторы - это вещества, которые влияют на скорость реакции, но при этом сами не расходуются.
| Изменение скорости химической реакции под воздействием катализатора называется катализом |
Реакции, протекающие с участием катализаторов, носят название каталитических реакций.
Основное действие катализатора - снижение энергии активации реакции, в результате чего возрастает количество эффективных соударений молекул.
Катализаторы могут ускорять реакцию в миллионы раз!
Различают два вида катализа:
- гомогенный (однородный) катализ - катализатор и реагенты образуют одну фазу: газ или раствор;
- гетерогенный (неоднородный) катализ - катализатор находится в виде самостоятельной фазы.
Механизм каталитических реакций очень сложен и до конца неизвестен. Согласно одной из научных гипотез, в каталитических реакциях катализатор и реагент вступают в реакцию с образованием промежуточного соединения, которое гороаздо активнее реагирует с другим исходным веществом с образованием конечного продукта реакции, при этом сам катализатор выделяется в свободном состоянии.
Обычно под катализаторами понимают вещества, ускоряющие реакцию, но есть вещества, замедляющие течение реакции - они называются ингибиторами.Биологические катализаторы называются ферментами. Ферменты являются белками.
Размер частиц реагентов
Возьмем спичку и поднесем ее к куску угля. Вряд ли уголь успеет загореться, пока спичка не погаснет. Измельчим уголь и повторим эксперимент - угольная пыль не просто загорится, а очень быстро загорится - произойдет взрыв (основная опасность в угольных шахтах). Что же происходит?
Измельчив уголь, мы тем самым резко увеличим площадь его поверхности. Чем больше площадь поверхности, на которой происходят столкновения молекул, тем выше скорость реакции.
Давление реагентов
Давление газообразных реагентов аналогично их концентрации - чем выше давление - тем выше концентрация - тем выше скорость реакции, т.к. количество соударений молекул возрастает. Как и концентрация, давление реагентов не "работает" в сложных реакциях.
