Что такое неметаллы
На заре становления химии, как науки, все элементы делились на две большие группы - металлы и неметаллы. Как ни странно, но такая классификация на "своих" и "чужих" актуальна и по сей день.
Несмотря на то, что в количественном отношении неметаллы значительно "проигрывают" металлам - их всего 22, да и то, в сумме с инертными газами, которые фактически являют собой отдельную "касту", тем не менее, неметаллы "господствуют" в нашем мире, занимая примерно 84% от массы всей почвы на Земле, 98,5% от массы всех растений и 97,6% от массы тела человека.
Азот, водород, кислород, сера, углерод и фтор являются органогенными элементами, являясь составными частями молекул белков, жиров, углеводов и нуклеиновых кислот.В довершении "важности" неметаллов скажем, что воздух, которым мы дышим, состоит из простых и сложных веществ, образованных неметаллами.
Познакомимся поближе с этими "чудо"-элементами, играющую такую важную роль в жизни на Земле.
Неметаллы в Периодической таблице Д.И.Менделеева находятся в правом верхнем углу, отграничиваясь диагональю "бор-астат" + водород и гелий,которые расположены в левом верхнем и правом верхнем углу таблицы.
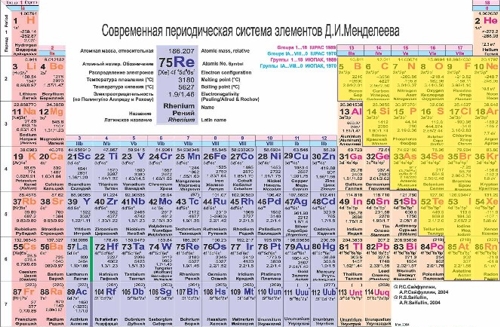
Рис. Расположение неметаллов в Периодической таблице (выделены желтым цветом)
Перечислим все неметаллы в порядке увеличения их атомных масс: водород, гелий, бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат, радон.
| Неметаллы - химические элементы, атомы которых могут принимать электроны для завершения своего внешнего электронного слоя |
Характерной особенностью многих неметаллов является наличие на внешнем электронном слое большого кол-ва электронов (от 4 до 8), при этом радиус атомов неметаллов мал по сравнению с атомами металлов.
Главное отличие неметаллов от металлов заключается в высокой энергии ионизации и большом сродстве к электрону - атомы неметаллов "охотно" присоединяют к себе электроны с целью завершения своего внешнего электронного слоя до устойчивой конфигурации ns2np6. Этим фактом и объясняются окислительные свойства неметаллов.
Особняком стоят инертные (благородные) газы, имеющие завершенный внешний энергетический уровень, и по этой причине они фактически не относятся ни к металлам, ни к неметаллам, занимая, таким образом, некое пограничное положение "на нашим, ни вашим".
К неметаллам инертные газы можно отнести лишь по их физическим признакам. Подробнее об инертных газах см. Атомы элементов 18(0) группы.
Положение неметаллов в Периодической системе и электронные конфигурации внешнего электронного слоя их атомов представлены на таблице внизу.
| 1 период | 1s1 | 1s2 | ||||
|---|---|---|---|---|---|---|
| H | He | |||||
| Группы | III | IV | V | VI | VII | VIII |
| Общее кол-во электронов на внешнем электронном слое | 3 | 4 | 5 | 6 | 7 | 8 |
| Электронная конфигурация внешнего слоя | ns2np1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 | ns2np6 |
| 2 период | B | C | N | O | F | Ne |
| 3 период | Si | P | S | Cl | Ar | |
| 4 период | As | Se | Br | Kr | ||
| 5 период | Te | I | Xe | |||
| 6 период | At | Rn | ||||
Из таблицы хорошо видно, что:
- неметаллы группы III (бор) для завершения своего внешнего электронного слоя должны присоединять 5 электронов;
- нементаллы группы IV (углерод, кремний) - 4 электрона;
- группы V (азот, фосфор, мышьяк) - 3 электрона;
- группы VI (кислород, сера, скандий, теллур) - 2 электрона;
- группы VII (фтор, хлор, бром, йод, астат) - 1 электрон;
- инертным газам ничего присоединять не надо - у них и так все в "порядке" с их внешним электронным слоем - он завершён.
Напомним, что окислительные свойства элементов в периодах возрастают слева направо, а в подгруппах - снизу вверх. Почему так происходит?
В горизонтальном направлении (в периодах) радиусы атомов неметаллов уменьшаются слева направо, например, радиус атома бора равен 0,091 нм, а у фтора = 0,064 нм. В то же время, в этом же направлении возрастает заряд ядра атома. Говоря другими словами, в направлении слева направо в периодах возрастает электроотрицательность элементов и сродство к электрону. То же самое происходит и в вертикальном направлении снизу вверх. Таким образом, фтор, находящийся в правом верхнем углу, имеет самый большой заряд ядра при самом маленьком радиусе атома, что позволяет ему очень легко присоединять недостающий единственный электрон. Поэтому, фтор характеризуется наибольшей электроотрицательностью и является самым сильным окислителем.
Если рассматривать изменение свойств неметаллов по вертикали, - прослеживается аналогичная картина, снизу вверх радиус атома элементов уменьшается, соответственно, возрастает неметалличность и окислительные свойства неметаллов.
В таблице, представленной ниже, приведены характеристики атомов-неметаллов 2-го периода (горизонтальная строка) и главной подгруппы VII группы (вертикальный столбец) - в ячейках указан элемент, в скобках - его порядковый номер в Периодической таблице, далее радиус атома, электронная конфигурация, и относительная электроотрицательность.
| B(5)-0,091 нм 2s22p1 2,0 |
C(6)-0,077 нм 2s22p2 2,5 |
N(7)-0,071 нм 2s22p3 3,0 |
O(8)-0,066 нм 2s22p4 3,5 |
F(9)-0,064 нм 2s22p5 4,0 |
| Cl(17)-0,099 нм 3s23p5 3,0 |
||||
| Br(35)-0,114 нм 4s23p5 2,8 |
||||
| I(53)-0,133 нм 5s23p5 2,2 |
||||
| At(85) 6s23p5 1,9 |
Неметаллы - это элементы главных подгрупп, как правило p-элементы, за исключением водорода, который является s-элементом.
Водород занимает двойственное положение в Периодической таблице - в главных подгруппах I и VII групп. Уникальность атома водорода заключается в том, что он имеет на своем единственном электронном слое единственный электрон, который может, как отдавать, проявляя свойства восстановителя, так и принимать электрон, проявляя свойства окислителя.
Отдает свой единственный электрон атом водорода труднее, чем атомы щелочных металлов, проявляя степень окисления +1. В других случаях атом водорода принимает электрон, проявляя степень окисления -1, как все галогены. Присоединение электрона к атому водорода происходит труднее, чем у галогенов. Подробнее о свойствах водорода см. "Водород".
