Что такое металлы
Ou brille l’ardent metal!.. - Люди гибнут за металл!
Наверняка, многие слышали эту фразу из куплетов Мефистофеля (опера Гуно "Фауст"). Трудно не согласиться с автором, ведь металлы действительно играют чрезвычайно важную роль в жизни человека.
Большинство, известных современной науке, химических элементов являются металлами (их более 80). Металлы входят в большинство неорганических соединений.
Наибольшую химическую активность проявляют щелочные и щелочноземельные металлы, которые образуют наиболее типичные для металлов химические соединения.
Еще одним существенным нюансом является тот факт, что соединения некоторых металлов Ia и IIa групп (литий, калий, магний, кальций) принимают участие во многих химико-биологических процессах, протекающих в клетках живых организмов.
Общая характеристика металлов
Все химические элементы делятся на металлы и неметаллы. В основе такого деления лежит различие в строении атомов элементов.
Неметаллы в таблице Периодической системы Менделеева занимают правый верхний угол (желтые ячейки на рисунке внизу):
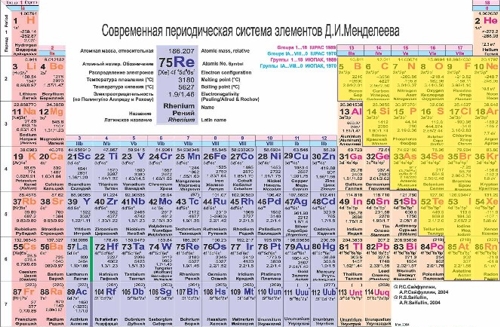
Все остальные, не желтые ячейки плюс водород и гелий - занимают металлы. Таким образом, неметаллы и металлы в Периодической таблице разделены условной диагональю бор-астат.
Химические элементы, расположенные в непосредственной близости от этой диагонали (алюминий, титан, галлий, германий, сурьма, теллур, астат), имеют двойственные свойства, реагируя в некоторых случаях, как металлы, а в других - как неметаллы.
Закономерности расположения элементов в периодах (слева-направо):
- Радиус атома - уменьшается;
- Заряд ядра - увеличивается;
- Электроотрицательность - увеличивается;
- Кол-во электронов на внешнем слое - увеличивается;
- Прочность связи внешних электронов с ядром атома - увеличивается;
- Способность отдавать электроны - уменьшается.
Исходя из вышеуказанных закономерностей, нетрудно догадаться, что металлы находятся в начале каждого периода (слева), а неметаллы - в конце (справа).
Атомы металлов:
- как правило, на внешнем электронном слое имеют 1-3 электрона (4 электрона у Ge, Sn, Pb; 5 - у Sb, Bi; 6 - у Po);
- имеют больший размер атома и меньший заряд его ядра, по сравнению с неметаллами своего периода;
- имеют высокопрочную связь внешних электронов с ядром атома;
- легко расстаются с валентными электронами, превращаясь в катионы.
При н.у. все металлы (за исключением ртути) являются твердыми веществами, обладающими прочной кристаллической решеткой, образованной за счет металлических связей. Между узлами кристаллической решетки находятся свободные электроны, которые могут переносить теплоту и проводить электрический ток. Поэтому, в отличие от неметаллов, металлы хорошо проводят тепло и обладают высокой электропроводностью.
Физические свойства металлов:
- твердые вещества (кроме ртути);
- обладают характерным металлическим блеском;
- обладают высокой электро- и теплопроводностью;
- обладают высокими механическими качествами: упругостью, пластичностью, прочностью.
Самыми мягкими металлами являются калий и натрий (их можно резать ножом), самый твердый металл - хром (царапает стекло).
Самый легкоплавкий металл ртуть (-38,9°C), самый тугоплавкий - вольфрам (3380°C).
Самая низкая плотность у лития (0,59 г/см3), самая высокая - у осмия (22,48 г/см3).
Еще одной характерной особенностью металлов является их способность намагничиваться:
- ферромагнетики обладают высокой способностью намагничиваться даже под действием незначительного магнитного поля (железо, никель);
- парамагнетики проявляются слабую способность к намагничиванию (алюминий, хром);
- диамагнетики не намагничиваются (олово, медь).
Химические свойства металлов
Выше уже было сказано, что металлы достаточно легко расстаются со своими электронами (окисляются), т.е. в окислительно-восстановительных реакциях являются восстановителями.
| Во всех химических реакциях металлы являются восстановителями, проявляя только положительные степени окисления Me0-ne- → Men+ |
- M - металл;
- e- - электрон;
- n - целое число.
Металлы характеризуются низкими величинами энергии ионизации (энергии, необходимой, для отрыва электрона от атома).
Восстановительная способность металлов:
- в периодах уменьшается слева-направо;
- в главных подгруппах увеличивается сверху-вниз.
Металл является более сильным восстановителем, чем он стоит левее в периоде и ниже в главной подгруппе.
Восстановительная активность металлов, в реакциях, протекающих в растворах веществ, зависит от места металла в электрохимическом ряду напряжений.

Химические реакции металлов с неметаллами (простыми веществами):
- с водородом металлы образуют гидриды:
Ca+H2 = CaH2 - гидрид кальция - с галогенами металлы образуют галогениды (соли):
Mg+Br2 = MgBr2 - бромид магния - с кислородом металлы образуют оксиды:
4Na+O2 = 2Na2O - оксид натрия - с серой металлы образуют сульфиды (соли):
Fe+S = FeS - сульфид железа - с углеродом металлы образуют карбиды:
Ca+2C = CaC2 - карбид кальция
Химические реакции металлов с сложными веществами:
- металлы от лития до натрия (см. ряд напряжений) вытесняют водород при н.у. с образованием щелочей:
2Na+2H2O = 2NaOH+H2↑ - металлы, стоящие левее водорода, реагируют с разбавленными кислотами с образованием солей и выделением водорода:
2Al+6HCl = 2AlCl3+3H2↑ - металлы реагируют с растворами солей менее активных металлов, восстанавливая при этом менее активный металл, с образованием соли более активного металла:
Fe+CuSO4 = FeSO4+Cu
Получение металлов
В свободном виде в природе присутствуют наименее активные металлы, встречаются они в виде так называемых самородков (кто не мечтает найти самородок золота). Так уж сложилось, что количество таких металлов на земле не так уж и много, поэтому, их еще называют драгоценными металлами - это золото, серебро, платина.
Остальные металлы, не имеющие "благородного" происхождения, т.к. являются достаточно активными, чтобы вступать во взаимодейcтвие с другими веществами, в природе присутствуют в разнообразных соединениях - сульфидах, сульфатах, оксидах, хлоридах, нитратах, фосфатах и проч.
Благодаря своим высоким практическим качествам, металлы заслужили "уважение" у наших далеких предков, которые, поняв их полезность, пытались найти способы извлечения металлов из соединений. Так зародилась целая отрасль, называемая металлургией.
Любой современный металлургический процесс заключается в восстановлении ионов металла, с получением на выходе металла в свободном виде.
Разновидности металлургических процессов:- Прометаллургия - получение металлов из их руд при помощи различных восстановителей при высоких температурах:
FeO+C = Fe+CO
Cr2O3+2Al = Al2O3+2Cr - Гидрометаллургия - получение металлов из раствора соли металла путем вытеснения более активным металлом:
- на первом этапе оксид металла растворяют в кислоте с целью получения раствора соли металла:
CuO+H2SO4 = CuSO4+H2O - на втором этапе из полученного раствора более активным металлом вытесняют "нужный" металл:
CuSO4+Fe = FeSO4+Cu
- на первом этапе оксид металла растворяют в кислоте с целью получения раствора соли металла:
- Электрометаллургия - получение металлов электролизом растворов (расплавов) их соединений (роль восстановителя выполняет электрический ток).
Сплавы металлов
По мере развития науки, человек понял, что соединяя воедино несколько различных металлов, можно получить вещество, которое будет превосходить по своим показателям исходные компоненты - так появились сплавы металлов.
Сплавы получают из расплавов металлов, которые в жидком виде хорошо растворяются и смешиваются друг с другом.
Главные разновидности сплавов металлов:
- Механическая смесь металлов представляет собой смесь очень мелких кристаллов отдельных металлов, как, например, перемешать цемент с песком;
- Твердые растворы представляют собой однородные кристаллы в узлах кристаллической решетки которых находятся атомы сплавляемых металлов;
- Интерметаллические соединения получаются взаимным растворением металлов, в результате которого атомы образуют "экзотические" соединения, например, Ag2Zn5, Cu3Zn.
Следует сказать, что сплавляются друг с другом не только металлы, в состав некоторых сплавов входят и неметаллы, с которыми металлы не только механически смешиваются, но и образуют атомные соединения, в результате чего полученный сплав обладает резко отличающимися физическими свойствами от исходных металлов. Современная наука разработала много разнообразных сплавов, которые обладают заранее заданными свойствами.
Популярные сплавы:
- Сталь - сплав железа с углеродом (обычно, до 1%) с легирующими добавками хрома, никеля, кремния, фосфора, марганца и проч.
- Чугун - сплав железа с углеродом (более 3%) с легирующими добавками.
- Бронза - сплав меди с оловом с легирующими добавками.
- Латунь - сплав меди с цинком.
- Мельхиор - сплав меди с никелем.
- Дюралюминий - сплав алюминия с медью (3-5%), магнием (1%), марганцем (1%).
- Амальгама - сплав металла с ртутью.
