Атомы элементов 17(VIIa) группы (галогены)
| Элемент | F | Cl | Br | I | At |
|---|---|---|---|---|---|
| Порядковый номер | 9 | 17 | 35 | 53 | 85 |
| Атомная масса (относительная) | 18,99 | 35,45 | 79,90 | 126,9 | 210 |
| Плотность (н.у.), г/см3 | 1,969 г/л | 3,21 г/л | 3,102 | 4,93 | 6,4 |
| tпл, °C | -219,7 | -100,95 | -7,25 | 113,5 | 230 |
| tкип, °C | -188,12 | -34,55 | 58,6 | 184,35 | 302 |
| Энергия ионизации, кДж/моль | 1680 | 1255 | 1142 | 1008 | 916 |
| Электронная формула | [He]2s22p5 | [Ne]3s23p5 | [Ar]3d104s24p5 | [Kr]4d105s25p5 | [Xe]4f145d106s26p5 |
| Электроотрицательность (по Поллингу) | 3,98 | 3,16 | 2,96 | 2,66 | 2,5 |
Электронные формулы инертных газов:
- He - 1s2;
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - [Ar]3d104s24p6;
- Xe - [Kr]4d105s25p6;
Соединения галогенов:
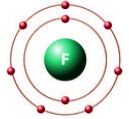
Рис. Строение атома фтора.
В 17 группу (VIIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 5 элементов: фтор, хлор, бром, йод, астат. Только астат является металлом, все остальные - неметаллы.
Элементы, входящие в группу фтора, называют галогенами (halos - соль; genes - рожденный).
- Фтор в нормальных условиях является двухатомным газом (F2) бледно-желтого цвета с резким запахом, напоминающим запах озона - это сильнейший окислитель и самый химически активный неметалл;
- Хлор в нормальных условиях является является ядовитым газом желтовато-зеленого цвета с резким запахом;
- Бром в нормальных условиях является ядовитой тяжелой едкой жидкостью красно-бурого цвета с неприятным запахом;
- Йод в нормальных условиях - кристаллическое вещество серо-черного цвета с фиолетовым металлическим блеском, легко испаряется, пары обладают резким запахом;
- Астат в нормальных условиях представляет собой нестабильные сильно радиоактивные темно-синие кристаллы.
Распространение галогенов в земной коре:
- Фтор - 0,027%;
- Хлор - 0,0045%;
- Бром - 0,00016%;
- Йод - 0,00003%;
- Астат самый редковстречающийся в земной коре элемент - суммарное содержание астата во всей земной коре равно 1 грамму.
Важнейшие минералы, в состав которых входят галогены:
- NaCl - галлит;
- NaCl·KCl - сильвинит;
- MgCl2·6H2O - бишофит;
- CaF2 - плавиковый шпат;
- Ca3(PO4)2·CaF2 - фторапатит;
- хлор, бром и йод содержится в морской воде.
В ряду от фтора к астату радиусы атомов (соответственно, количество электронов и орбиталей) увеличиваются, что приводит к уменьшению энергии ионизации и электроотрицательности - неметаллические свойства снижаются, а металлические увеличиваются.
У всех галогенов на внешнем энергетическом уровне находится 7 электронов: 2 (спаренных) на s-подуровне и 5 (четыре спаренных и один неспаренный) на p-подуровне + свободная орбиталь d-подуровня (исключение составляет фтор, не имеющий d-орбитали, поэтому он проявляет степень окисления только -1).
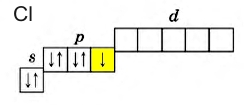
Рис. Внешний энергетический уровень атома хлора в невозбужденном состоянии.
Наличие свободной d-орбитали значительно расширяет валентные возможности галогенов. Например, атом хлора в невозбужденном состоянии имеет всего 1 неспаренный электрон, который может участвовать в образовании ковалентной связи. Реагируя с менее электроотрицательным атомом, хлор принимает один электрон, проявляя степень окисления -1 (HCl; HBr; KBr; NaCl). Вступая в реакции с более электроотрицательными атомами, образованная электронная пара смещается к более электроотрицательному элементу, хлор отдает своей неспаренный электрон, проявляя степень окисления +1 (HClO; KClO).
Переходя в возбужденное состояние (электроны с s- и p-подуровня "перескакивают" на d-подуровень), атом галогена (исключение составляет фтор), в зависимости от количества поглощаемой энергии, может образовывать 3, 5 или 7 ковалентных связей.
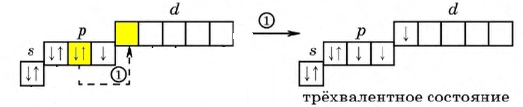
Рис. Возбужденный атом галогена, степень окисления +3.
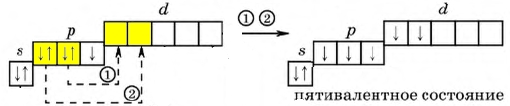
Рис. Возбужденный атом галогена, степень окисления +5.
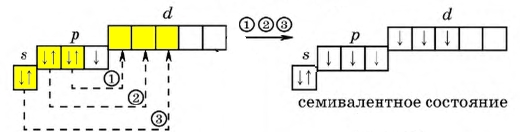
Рис. Возбужденный атом галогена, степень окисления +7.
Возможные степени окисления галогенов:
- -1: HCl; HBr; KBr; NaCl;
- 0: Br2; Cl2 F2;
- +1: HClO; KClO;
- +3: HClO2; NaClO2;
- +5: HClO3; NaClO3;
- +7: HClO4; NaClO4.
Таким образом, галогены являются типичными неметаллами, в реакциях проявляют окислительные свойства, что объясняется их максимальным сродством к электрону и наибольшими значениями электроотрицательности (см. таблицу электроотрицательности) среди элементов каждого периода.
Наиболее характерной для атомов галогенов степенью окисления является -1:
H-1F-1, Na-1F-1, Ca+2Br-1, H+1Br-1
В подгруппе окислительная способность галогенов снижается по направлению сверху вниз (от фтора к йоду): фтор является самым сильным окислителем, поскольку имеет самый маленький радиус атома по сравнению с другими галогенами.
Ионы галогенов, кроме фтора, могут отдавать электроны, проявляя восстановительные свойства. Восстановительная способность галогенид-ионов возрастает от хлорид-иона до йодид-иона.
Все галогены легко реагируют с водородом, образуя галогеноводороды: Hal2+H2=2HHal
Физические свойства галогенов
- в ряду от фтора к астату повышаются температуры плавления и кипения галогенов;
- имеют резкий неприятный запах;
- ядовиты;
- при н. у. фтор и хлор - газы; бром - жидкость; йод - твердое кристаллическое вещество.
Химические свойства галогенов
- галогены химически очень активные вещества;
- F2, Cl2, Br2, I2 плохо растворяются в воде по причине своей неполярности;
- с простыми веществами образуют галогениды (исключение составляют инертные газы);
- галогены очень сильные окислители (окислительная способность снижается в ряду от фтора к йоду);
- при н. у. и при нагревании реагируют с металлами с выделением большого количества тепла: 2Na + Cl2 = 2NaCl;
- фтор является наиболее реакционноспособным галогеном, вступая в реакцию даже с инертными газами: Ar + 2F2 = ArF4;
- хлор реагирует с большинством неметаллов: S + Cl2 = SCl2;
- с водородом образуют галогеноводороды (фтор и хлор реагируют с выделением большого кол-ва тепла): H2 + Hal2 = 2HHal;
- реагируют с водой:
- фтор окисляет воду: 2F2 + 2H2O = 4HF + O2;
- хлор реагирует при воздействии ультрафиолетового облучения: 2Cl2 + 2H2O = 4HCl + O2;
- при н. у. хлор подвергается гидролизу: Cl2 + H2O = HCl + HClO.
- реагируют с щелочами в водных растворах: Cl2 + 2KOH = KCl + KClO + H2O;
- галоген с более высокими окислительными свойствами вытесняет из соединений менее активный галоген (окислительные свойства галогенов падают в ряду от фтора к йоду): F2 + 2KCl = 2KF + Cl2; Br2 + 2KI = 2KBr + I2.
- реагируют с органическими веществами: CH4 + Cl2 → CH3Cl + HCl.
Получение галогенов
- Фтор получают электролизом расплавов KF или HF: 2HF = F2 + H2;
- Хлор получают:
- электролизом водного раствора NaCl (промышленный способ): 2NaCl + 2H2O = 2NaOH + Cl2 + H2;
- действием соляной кислоты на оксид марганца (лабораторный способ): 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O.
- Бром получают из морской воды с высоким содержанием KBr: 2KBr + Cl2 = Br2 + 2KCl;
- Йод - из вод нефтегазовых месторождений с высоким содержанием KI.
Применение галогенов
- Фтор применяют при производстве фреона и тефлона;
- Хлор используют в производстве соляной кислоты, хлорной извести, хлоридов, разнообразных хлорорганических веществ, для получения брома, йода, в качестве дезинфецирующего средства питьевой воды;
- Бром нашел применение в производстве красителей, лекарственных средств, броморганических веществ, для получения йода;
- Йод используют в медицине в качестве антисептического средства, в металлургии - для очистки некоторых металлов, в органическом синтезе в качестве катализатора.
