Атомы элементов 18(0) группы (инертные газы)
| Элемент | He | Ne | Ar | Kr | Xe | Rn |
|---|---|---|---|---|---|---|
| Порядковый номер | 2 | 10 | 18 | 36 | 54 | 86 |
| Атомная масса (относительная) | 4 | 20,17 | 39,94 | 83,80 | 131,3 | 222,01 |
| tпл, °C | -272 | -249 | -189 | -157 | -112 | -71 |
| tкип, °C | -269 | -246 | -186 | -153 | -108 | -62 |
| Энергия ионизации, кДж/моль | 2361,3 | 2080 | 1520,6 | 1350,8 | 1170 | 1037 |
| Электронная формула | 1s2 | 1s22s22p6 | 1s22s22p63s23p6 | [Ar]3d104s24p6 | [Kr]4d105s25p6 | [Xe]4f145d106s26p5 |
| Электроотрицательность (по Поллингу) | 4,5 | 4,4 | 4,3 | 3,0 | 2,6 | 2,2 |
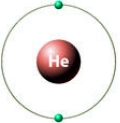
Рис. Строение атома гелия.
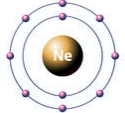
Рис. Строение атома неона.
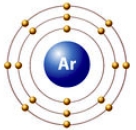
Рис. Строение атома аргона.
В 18 группу периодической таблицы химических элементов Д. И. Менделеева входят 6 элементов (при н. у. являются газами): гелий, неон, аргон, криптон, ксенон, радон.
Данная группа получила название инертных или благородных газов, поскольку элементы, входящие в 18 группу, обладают крайне низкой реакционной способностью, что обусловлено завершенностью их внешнего энергетического уровня, на котором находится 8 электронов (у гелия - 2), поэтому, благородные газы "не хотят" ни отдавать, ни принимать электроны от других атомов. По этой причине молекулы благородных газов состоят только из одного атома.
Атомы инертных газов имеют самые высокие энергии ионизации, постепенно уменьшающиеся в ряду от гелия к радону, что объясняется увеличением атомных радиусов (удаленные электроны хуже притягиваются ядром атома). В атомах гелия и неона электроны так сильно удерживаются ядром, что эти два газа не вступают в реакции вообще (современной науке неизвестны химические соединения гелия или неона), а вот остальные четыре благородных газа при определенных условиях могут реагировать с другими атомами.
Содержание благородных газов в природе:
- Гелий является самым распространенным элементом (после водорода) космического пространства, однако, на Земле его содержится немного, в минералах клевеите и монаците, также гелий входит в состав природных горючих газов.
- Неона в земной коре содержится 0,00005 г/т, также неон присутствует в атмосферном воздухе.
- Аргон является самым распространенным на Земле благородным газом (в земной коре его содержится 0,000004%; в атмосферном воздухе - 0,93%)
- Криптон, ксенон и радон присутствуют в земной атмосфере, а также в некоторых урансодержащих минералах.
- Радон является радиоактивным элементом, определяя естественную степень радиоактивности воздуха.
Физические свойства благородных газов
- инертные газы не имеют цвета или запаха;
- трудно поддаются сжижению;
- в ряду от гелия к радону возрастает поляризуемость молекул и растворимость в воде;
- инертные газы хорошо растворяются в органических растворителях (спирте, бензине);
- при низких температурах благородные газы адсорбируются на активированном угле, что позволяет проводить их разделение и очистку;
- гелий обладает очень высокой проникающей способностью, способен проникать через стенки пластмассовых, стеклянных и некоторых металлических сосудов.
Химические свойства благородных газов
- благородные газы обладают крайне низкой реакционной способностью, которая увеличивается по направлению от гелия к радону;
- изучать химические соединения радона (самого активного инертного газа) достаточно сложно по причине его высокой радиоактивности;
- наиболее изученным, с точки зрения создания химических соединений, из всех инертных газов является ксенон, обладающий относительно высокой активностью и малой радиоактивностью - "охотнее" всего ксенон реагирует с фтором и кислородом, что объясняется высокой электроотрицательностью этих элементов (F2 и O2 сильные окислители);
- при низких температурах инертные газы (кроме гелия) образуют с водой гидраты (клатраты), когда атомы благородных газов включаются в пустоты, имеющиеся в ледяной структуре: Ar·6H2O;
- все соединения благородных газов с фтором или кислородом проявляют сильные окислительные свойства: RnF2, KrF2, Na2XeO4, H4XeO6.
Получают инертные газы (кроме радона) фракционной перегонкой жидкого атмосферного воздуха. Гелий получают также из минералов или природного газа. Аммиак можно получить, как побочный продукт при синтезе аммиака.
Среди всех инертных газов наибольшее применение нашел гелий, который используется в качестве теплоносителя ядерных реакторов, в производстве полупроводников, для заполнения воздушных оболочек различных летательных аппаратов, в дыхательных аппаратах глубоководного погружения (компонент дыхательной смеси), как хладагент при получении сверхпроводников. Аргон нашел применение для создания инертной атмосферы при сварочных работах (аргонная сварка). Неон и криптон применяют в качестве наполнителя ламп накаливания. Благодаря своему яркому свечению, неон используется в сигнальных лампах радиоэлектронной аппаратуры, лампах-индикаторах, рекламных лампах (неоновая реклама).
