Атомы элементов 1(Ia) группы
| Элемент | Li | Na | K | Rb | Cs | Fr |
|---|---|---|---|---|---|---|
| Порядковый номер | 3 | 11 | 19 | 37 | 55 | 87 |
| Атомная масса (относительная) | 6,94 | 22,98 | 39,09 | 85,46 | 132,9 | 223 |
| Плотность (н.у.), г/см3 | 0,534 | 0,971 | 0,856 | 1,53 | 1,87 | 1,87 |
| tпл, °C | 180 | 97 | 63 | 39 | 28 | 18 |
| tкип, °C | 1339 | 882 | 773 | 668 | 667 | 640 |
| Энергия ионизации, кДж/моль | 513,3 | 495,8 | 418,8 | 403,0 | 375,7 | 380 |
| Электронная формула | [He]2s1 | [Ne]3s1 | [Ar]4s1 | [Kr]5s1 | [Xe]6s1 | [Rn]7s1 |
| Электроотрицательность (по Поллингу) | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,7 |
Электронные формулы инертных газов:
- He - 1s2;
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - [Ar]3d104s24p6;
- Xe - [Kr]4d105s25p6;
- Rn - [Xe]4f145d106s26p6.
Соединения щелочных металлов:
В 1 группу(Ia группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 металлов: литий, натрий, калий, рубидий, цезий, франций (см. таблицу выше). Эти металлы принято называть щелочными, поскольку при взаимодействии с водой эти металлы (и их оксиды) образуют щелочи.
Самым распространенным из щелочных металлов в земной коре является натрий (2,3% по массе), далее идут калий (2,1%), рубидий (0,009%), литий (0,002%), цезий (0,0003%). Щелочные металлы по причине их высокой активности в природе в свободном виде не встречаются.
Природные соединения и минералы, богатые натрием и калием:
- NaCl - галит;
- KCl - сильвит;
- KCl·NaCl - сильвинит;
- K[AlSiO3O8] - ортоклаз.
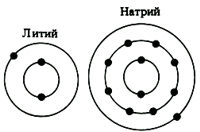
Все атомы элементов 1(Ia) группы на внешнем энергетическом уровне имеют по одному валентному s-электрону (см. Электронная конфигурация атомов), с которым в химических соединениях достаточно легко "расстаются" с целью завершения внешнего энергетического уровня, который становится в таком случае устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов.
Таким образом, отдавая "ненужный" электрон щелочные металлы в химических соединениях проявляют степень окисления +1.
Нетрудно заметить, что с ростом порядкового номера щелочного металла увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от лития к францию (по мере увеличения радиуса атома щелочного элемента) - франций со своим s-электроном расстается гораздо легче, чем литий. Говоря другими словами, с ростом радиуса атома (номера элемента) возрастает реакционная (восстановительная) способность щелочного металла.
Физические свойства щелочных металлов
Многие физические свойства щелочных металлов обусловлены металлическими связями, возникающими между атомами этих металлов по причине их низкой энергии ионизации:
- щелочные металлы имеют серебристо-белый цвет;
- низкую плотность;
- низкую температуру плавления (температуры плавления уменьшаются в подгруппе сверху-вниз);
- обладают высокой пластичностью;
- высокой электро- и теплопроводностью.
Химические свойства щелочных металлов
Как уже было сказано выше, щелочные металлы очень легко вступают в химические реакции с другими элементами, отдавая при этом "ненужный" валентный электрон (см. Валентность) и превращаясь в положительно заряженный ион (катион).
Щелочные металлы легко реагируют со многими простыми веществами:
- с кислородом щелочные металлы образуют оксиды (Li), пероксиды (Na), суперпероксиды:
4Li + O2 = 2Li2O; 2Na + O2 = Na2O2; K + O2 = KO2; - с серой образуют сульфиды:
2Na+S = Na2S - с водородом образуют гидриды:
2Na+H2 = 2NaH - взаимодействуют с галогенами (F, Cl, Br, I), образуя галогениды:
2Li + F2 = 2LiF; - бурно реагируют с водой (активность возрастает с ростом атомного номера - натрий воспламеняется, а рубидий взрывается):
2Na + 2H2O = 2NaOH + H2; - бурно реагируют с кислотами:
- с соляной и разбавленной серной реагируют с выделением водорода:
2K + H2SO4(рзб) = K2SO4 + H2; - с концентрированной серной восстанавливают серу до степени окисления -2:
8Na + 5H2SO4(кнц) = 4Na2SO4 + H2S + 4H2O; - с разбавленной азотной продуктом восстановления является нитрат аммония (ст. ок. -4) или аммиак:
8Na + 10HNO3(рзб) = 8NaNO3 + NH4NO3 + 3H2O; - с концентрированной азотной продуктом восстановления является оксид азота (I):
8Na + 10HNO3(кнц) = 8NaNO3 + N2O + 5H2O.
- с соляной и разбавленной серной реагируют с выделением водорода:
Щелочные металлы окрашивают пламя в следующие цвета:
- Li - светло-красный;
- Na - желтый;
- K - сине-фиолетовый;
- Rb - темно-красный;
- Cs - бледно-голубой.
Получение и применение щелочных металлов
Промышленным способом щелочные металлы получают электролизом расплавов хлоридов (гидроксидов) этих металлов.
NaCl → Na++Cl- (700°C) Na++e- → Na0 (катод) 2Cl--2e- → Cl20 (анод) 2NaCl → 2Na+Cl2↑
Металлотермические методы получения щелочных металлов (рубидий и цезий получают в вакуумной среде):
- 3LiO + 2Al = Al2O3 + 3Li;
- Na + KCl = NaCl + K;
- 2RbCl + Ca = 2Rb + CaCl2;
- 2CsCl + Mg = 2Cs + MgCl2.
Применение щелочных металлов:
- Li:
- придает легкость сплавам, его применяют при производстве медных, магниевых и алюминиевых сплавов;
- в металлургии при помощи лития удаляют из металлических расплавов шлаки, содержащие азот, кислород и серу;
- в органическом синтезе.
- Na:
- в качестве наполнителей газоразрядных ламп;
- в качестве теплоносителя в ядерных реакторах;
- в органическом и неорганическом синтезе;
- в металлургии при производстве металлов и сплавов.
- K:
- для получения металлов;
- в качестве теплоносителя в ядерных реакторах;
- в фотоэлементах в качестве преобразователя световой энергии в электрическую.
- Rb, Cs:
- в источниках инфракрасного излучения;
- в фотоэлементах.
