Атомы элементов 15(Va) группы
| Элемент | N | P | As | Sb | Bi |
|---|---|---|---|---|---|
| Порядковый номер | 7 | 15 | 33 | 51 | 83 |
| Атомная масса (относительная) | 14,00674 | 30,973761 | 74,92 | 121,75 | 208,98 |
| Плотность (н.у.), г/см3 | 0,808 | 1,82 | 5,73 | 6,691 | 9,79 |
| tпл, °C | -209,86 | 44,14 | 615 - t возгонки 817 - под давлением 37 атм. |
631 | 271 |
| tкип, °C | -195,8 | 280 | 1635 | 1564 | |
| Энергия ионизации, кДж/моль | 1401,5 | 1011,7 | 946,2 | 833,7 | 703,2 |
| Электронная формула | [He]2s22p3 | [Ne]3s23p3 | [Ar]3d104s24p3 | [Kr]4d105s25p3 | [Xe]4f145d106s26p3 |
| Электроотрицательность (по Поллингу) | 3,04 | 2,19 | 2,18 | 2,05 | 2,02 |
Электронные формулы инертных газов:
- He - 1s2;
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - [Ar]3d104s24p6;
- Xe - [Kr]4d105s25p6;
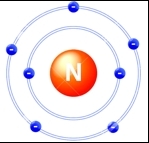
Рис. Строение атома азота.
В 15 группу (Va группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 5 элементов: азот, фосфор, мышьяк, сурьма, висмут (см. таблицу выше). Азот, фосфор, мышьяк - неметаллы, сурьма является металлоподобным веществом, висмут - металл.
Содержание элементов 15(Va) группы в земной коре (по массе):
- Азот: 75,6% (в атмосфере); 0,01%;
- Фосфор - 0,085%;
- Мышьяк - 0,00017%;
- Сурьма - 0,00005%;
- Висмут - 0,00002%.
Безусловно, из всех элементов 15(Va) группы наибольшее значение имеют азот (см. Азот и его соединения) и фосфор (см. Фосфор и его соединения).
В ряду от азота к висмуту по мере увеличения атомного радиуса, неметаллические свойства элементов уменьшаются, а металлические - возрастают, что обусловлено уменьшением силы притяжения внешних валентных электронов (см. Валентность).
У всех элементов 15(Va) группы на внешнем энергетическмо уровне присутствуют два спаренных s-электрона и 3 неспаренных p-электрона, что позволяет атомам проявлять самые разнообразные степени окисления, начиная от -3 и до +5, в зависимости от условий конкретной химической реакции и элемента, с которым происходит образование связи. Но, поскольку атомы элементов подгруппы азота имеют 3 неспаренных электрона, наиблее типичной валентностью для них является 3.
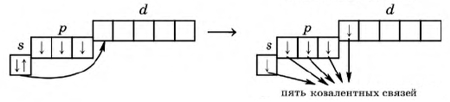
Рис. Переход атома фосфора в возбужденное состояние.
Атом азота не может иметь валентность, равную V, поскольку, на его втором энергетическом уровне нет d-подуровня, и атом азота не может переходить в возбужденное состояние. Также малохарактерны отрицательные степени окисления для сурьмы и висмута.
Элементы группы азота способны реагировать с водородом, образуя следующие соединения: NH3; PH3; AsH3; SbH3; BiH3. Поскольку по мере увеличения радиуса атома от азота к висмуту длина водородной связи увеличивается (соответственно, снижается ее прочность), электроотрицательность (соответственно, полярность связи) атомов снижается, однако, в водных растворах данные соединения кислотных свойств не проявляют, т. е., не диссоциируют (см. Диссоциация) с отщеплением протона, что объясняется достаточной прочностью водородной связи (в отличие от галогенов и элементов VI группы).
Элементы 15(Va) группы образуют оксиды двух видов: N2O3, N2O5. Кислотные свойства, а также устойчивость, таких оксидов в ряду от азота к висмуту уменьшаются. Соответственно, уменьшаются кислотные свойства и устойчивость их гидроксидов.
Свойства оксидов элементов группы азота:
- Кислотные оксиды (азот, фосфор):
- степень окисления +3: N2O3; P2O3; P4O6;
- степень окисления +5: N2O5;
- Основные оксиды (висмут):
- степень окисления +3: Bi2O3;
- степень окисления +5: Bi2O5;
- Амфотерные оксиды (мышьяк, сурьма):
- степень окисления +3: As2O3; Sb2O3;
- степень окисления +5: As2O5; Sb2O5;
Свойства гидроксидов элементов группы азота:
- Кислотные оксиды (азот, фосфор):
- степень окисления +3: HNO2; H3PO3;
- степень окисления +5: HNO3; H3PO4;
- Основные оксиды (висмут):
- степень окисления +3: Bi(OH)3;
- степень окисления +5: нет.
- Амфотерные оксиды (мышьяк, сурьма):
- степень окисления +3: H3AsO3; Sb(OH)3;
- степень окисления +5: H3AsO4; для сурьмы нет.
Кислотным оксидам подгруппы азота соответствуют кислоты двух типов (HЭO2 или H3ЭO3, а также HЭO3 или H3ЭO4):
N2+3O3 → HN+3O2 (азотистая к-та) N2+5O5 → HN+5O3 (азотная к-та) P2+3O3 → HP+3O2(H3P+3O3) (фосфористые к-ты) P2+5O5 → HP+5O3(H3P+5O4) (фосфорные к-ты)
Азот может образовывать только метакислоты, остальные элементы подгруппы азота образуют, как метакислоты, так и ортокислоты: HPO3 (метафосфорная к-та), H3PO4 (ортофосфорная к-та).
Элементы 15-й группы могут образовывать газообразные водородные соединения: NH3 (аммиак), PH3 (фосфин), AsH3 (арсин), SbH3 (стибин), BiH3 (висмутин).
Но, в отличие от галогеноводородов и халькогеноводородов, водные растворы аммиака и фосфина являются не кислотами, а слабыми основаниями:
NH3+H2O ↔ NH4OH ↔ NH4++OH- PH3+H2O ↔ PH4OH ↔ PH4++OH-
Арсин, стибин и висмутин весьма малоустойчивые соединения, разлагающиеся на простые вещества уже при комнатной температуре.
