Атомы элементов 13(IIIa) группы
| Элемент | B | Al | Ga | In | Tl |
|---|---|---|---|---|---|
| Порядковый номер | 5 | 13 | 31 | 49 | 81 |
| Атомная масса (относительная) | 10,81 | 26,98 | 69,72 | 114,82 | 204,37 |
| Плотность (н.у.), г/см3 | 2,34 | 2,7 | 5,91 | 7,31 | 11,849 |
| tпл, °C | 2075 | 660 | 29,8 | 156 | 304 |
| tкип, °C | 3865 | 2518 | 2204 | 2072 | 1473 |
| Энергия ионизации, кДж/моль | 800,6 | 577,4 | 578,8 | 558,3 | 589,3 |
| Электронная формула | [He]2s22p1 | [Ne]3s23p1 | [Ar]3d104s24p1 | [Kr]4d105s25p1 | [Xe]4f145d106s26p1 |
| Электроотрицательность (по Поллингу) | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Электронные формулы инертных газов:
- He - 1s2;
- Ne - 1s22s22p6;
- Ar - 1s22s22p63s23p6;
- Kr - [Ar]3d104s24p6;
- Xe - [Kr]4d105s25p6;
Рис. Строение атома алюминия.
В 13 группу (IIIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 элементов: бор, алюминий, галлий, индий, таллий, унунтрий (см. таблицу выше). Бор является неметаллом, остальные элементы - металлы.
Самым распространенным в земной коре элементом 13(IIIa) группы является алюминий (третий элемент по распространенности) (8,2% по массе), далее идут: галлий (0,0018%), бор (0,0003%), таллий (0,00006%), индий (4,9·10-6).
В природе элементы 13(IIIa) группы в свободном виде не встречаются, их атомы содержатся во многих соединениях:
- Природные соединения в состав которых входит бор:
- Na2B4O7·10H2O - бура;
- H3BO3 - сасолин и другие природные борные кислоты.
- Важнейшим природным соединением алюминия являются алюмосиликаты (оксид алюминия и кремния), входящие в состав многих горных пород и глин. Важнейшими минералами алюминия являются:
- Al2O3·nH2O - боксит;
- Na3[AlF6] - криолит;
- Al2O3 - корунд и его разновидности.
- Природное соединение галлия:
- CuGaS2 - галлит.
- Природное соединение индия:
- FeIn2S4 - индит.
- Природное соединение таллия:
- TlAsS2 - лорандит.
На внешнем энергетическом уровне элементов 13(IIIa) группы находится 3 электрона (2 на s-подуровне + 1 на p-подуровне).
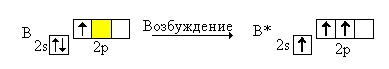
При переходе атома в возбужденное состояние один s-электрон внешнего подуровня переходит на свободную p-орбиталь, в таком виде атомы могут отдавать на построение ковалентных связей в соединениях все три электрона своего внешнего уровня, проявляя степень окисления +3 (исключением является таллий, у которого более устойчивой является степень окисления +1).
С ростом порядкового номера химического элемента увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от бора (неметалл) к алюминию (металл, но его гидроксид является амфотерным веществом) и далее к галлию, индию, таллию (типичные металлы). В этом ряду активность металлов и их восстановительные свойства возрастают.
Наибольшее значение из всех шести элементов 13(IIIa) группы имеют бор (См. Бор и его соединения) и алюминий (См. Алюминий и его соединения).
