Атомы переходных элементов (металлов)
К переходным элементам относят d- и f-элементы - у которых электроны заполняют d- и f-орбитали (см. Электронная структура атомов).
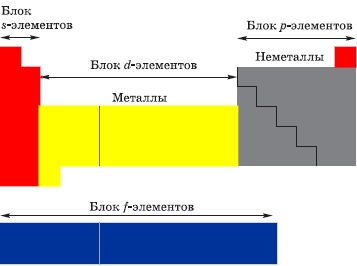
Элементы переходной группы в Периодической таблице Д. И. Менделеева расположены в побочных подгруппах больших периодов, как бы вклиниваясь между s- и p-элементами (см. рисунок выше) - отсюда, собственно, и получилось название элементов группы.
На начало 21 столетия наука знала 68 переходных элементов:
- 10 d-элементов 4-го периода: скандий (Sc), титан (Ti), ванадий (V), хром (Cr), марганец (Mn), железо (Fe), кобальт (Co), никель (Ni), медь (Cu), цинк (Zn);
- 10 d-элементов 5-го периода: иттрий (Y), цирконий (Zr), ниобий (Nb), молибден (Mo), технеций (Tc), рутений (Ru), родий (Rh), палладий (Pd), серебро (Ag), кадмий (Cd);
- 10 d-элементов 6-го периода: лантан (La), гафний (Hf), тантал (Ta), вольфрам (W), рений (Re), осмий (Os), иридий (Ir), платина (Pt), золото (Au), ртуть (Hg);
- 10 d-элементов 7-го периода: актиний (Ac), резерфордий (Rf), дубний (Db), сиборгий (Sg), борий (Bh), хассий (Hs), мейтнерий (Mt), коперниций (бывший унунбий) (Cn), рентгений (унунуний) (Rg), дармштадий (унуннилий) (Ds);
- 14 f-элементов 6-го периода (лантаноиды): церий (Ce), празеодим (Pr), неодим (Nd), прометий (Pm), самарий (Sm), европий (Eu), гадолиний (Gd), тербий (Tb), диспрозий (Dy), гольмий (Ho), эрбий (Er), тулий (Tm), иттербий (Yb), лютеций (Lu);
- 14 f-элементов 7-го периода (актиноиды): торий (Th), протактиний (Pa), уран (U), нептуний (Np), плутоний (Pu), амерций (Am), кюрий (Cm), берклий (Bk), калифорний (Cf), эйнштейний (Es), фермий (Fm), менделевий (Md), нобелий (No), лоуренсий (Lr).
Максимальное число d- (10) и f-элементов (14) в группах обусловлено тем фактом, что d-подуровень содержит 5 d-орбиталей, каждая из которых может вместить два электрона (всего 10); соответственно f-подуровень содержит 7 f-орбиталей, на которых может максимально разместиться 14 электронов (подробнее см. Таблицу электронных конфигураций атомов химических элементов по периодам).
Главное отличие от s- и p-элементов, у которых заполняется внешний энергетический уровень, заключается в том, что у d- и f-элементов происходит заполнение внутренних подуровней (d- и f-подуровней соответственно). Поскольку все переходные элементы являются металлами, то данную группу еще называют "переходными металлами".
d-элементы характеризуются медленным возрастанием атомных радиусов с увеличением кол-ва электронов. Большинство d-элементов проявлют степень окисления +2 (на внешнем энергетическом уровне у большинства переходных элементов находится по два s-электрона). Но, поскольку у переходных элементов в образовании химических связей могут принимать участие d- и f-электроны предпоследнего энергетического уровня, переходные металлы могут проявлять гораздо большее число степенй окисления, например, рутений от 0 до +8 (высшие степени окисления переходные элементы проявляют с наиболее электроотрицательными элементами: хлором, фтором, кислородом).
Наиболее распространенные степени окисления переходных металлов соответствуют атомам с максимально устойчивыми электронными конфигурациями, которыми являются d0, d5, d10, например, Zn2+(d10) более устойчив в отличие от Fe2+(d6).
В низших степенях окисления d-элементы проявляют основные свойства - Mn(OH)2, в средних - амфотерные - Mn(OH)4; в высших - кислотные HMNO4.
В группах переходных элементов с увеличением атомного номера металлические свойства элементов ослабляются, энергия ионизации возрастает, уменьшаются восстановительные свойства, что объясняется медленным увеличением атомных радиусов в группах и ростом зарядов ядер атомов, вследствие чего валентные электроны более сильно притягиваются к ядру.
Все d-элементы обладают высокой каталитической активностью, хорошей электропроводимостью, им присущи магнитные свойства. Химические свойства d-элементов существенно отличаются от свойств s- и p-элементов по причине наличия d-орбитали, что объясняет наличие большого числа степень окисления d-элементов.
Подгруппа меди (Ib)
| Элемент | Cu | Ag | Au |
|---|---|---|---|
| Порядковый номер | 29 | 47 | 79 |
| Атомная масса (относительная) | 63,546 | 107,8682 | 196,96655 |
| Плотность (н.у.), г/см3 | 8,92 | 10,5 | 19,3 |
| tпл, °C | 1083,4 | 961,93 | 1064,18 |
| tкип, °C | 2567 | 2212 | 2856 |
| Энергия ионизации, кДж/моль | 745 | 730 | 889 |
| Электронная формула | [Ar]3d104s1 | [Kr]4d105s1 | [Xe]4f145d106s1 |
| Электроотрицательность (по Поллингу) | 1,90 | 1,93 | 2,54 |
Электронные формулы инертных газов:
- Ar - 1s22s22p63s23p6;
- Kr - [Ar]3d104s24p6;
- Xe - [Kr]4d105s25p6;
В 11 группу (Ib) входят медь (Cu), серебро (Ag), золото (Au).
Отличительность особенностью элементов подгруппы меди является полностью заполненный предвнешний энергетический d-подуровень (на внешнем s-подуровне находится один неспаренный электрон), что обусловливает невысокую химическую активность элементов данной подгруппы и в частности "благородство" серебра и золота.
В зависимости от степени возбуждения элементы подгруппы меди отдают для связи с другими элементами от 1 до 3 электронов, проявляя степени окисления +1, +2, +3. Наиболее устойчивые степени окисления: для меди +1 и +2; для сребера +1; для золота +1 и +3.
Подгруппа цинка (IIb)
| Элемент | Zn | Cd | Hg |
|---|---|---|---|
| Порядковый номер | 30 | 48 | 80 |
| Атомная масса (относительная) | 65,39 | 112,411 | 200,59 |
| Плотность (н.у.), г/см3 | 7,13 | 8,65 | 13,546 |
| tпл, °C | 420 | 321 | -38,86 |
| tкип, °C | 907 | 765 | 356,6 |
| Энергия ионизации, кДж/моль | 905 | 867 | 1006 |
| Электронная формула | [Ar]3d104s2 | [Kr]4d105s2 | [Xe]4f145d106s2 |
| Электроотрицательность (по Поллингу) | 1,65 | 1,69 | 1,9 |
В 12 группу (IIb) входят цинк (Zn), кадмий (Cd), ртуть (Hg).
Элементы подгруппы цинка проявляют высокую стабильность, что объясняется завершенным предвнешним d-подуровнем, при этом на внешнем s-подуровне находятся одна спаренная электронная пара, которая может вступать в образование химических связей с другими атомами, поэтому, элементы 12 группы проявляют постоянную валентность, равную двум, в соединениях они проявляют степень окисления +2.
Устойчивость гидроксидов в ряду от цинка к ртути снижается: Zn(OH)2, Cd(OH)2 являются устойчивыми веществами, ртуть гидроксида не образует.
