Что такое электролиз
Если в электролит опустить два электрода, и подсоединить их к источнику питания, то отрицательно заряженные ионы (анионы), находящиеся в электролите, начнут притягиваться к положительному электроду (аноду), а положительно заряженные ионы (катионы) - к отрицательному электроду (катоду) - в цепи возникнет постоянный ток.
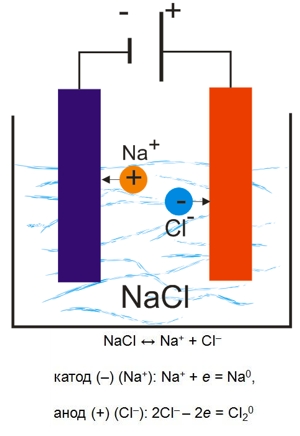
Катионы, достигнув поверхности катода, будут присоединять к себе электроны металла (восстанавливаться); анионы на аноде будут отдавать свои электроны (окисляться).
На рисунке выше показан простейший случай электролиза - в расплаве хлорид натрия диссоциирует на катионы натрия и анионы хлора. Под действием электрического тока Na+ восстанавливаются на катоде, Cl- - окисляются на аноде.
Уравнение электролиза будет иметь вид:
2Na++Cl- = 2Na0+Cl20 2NaCl = 2Na+Cl↑
В результате электролиза на аноде будет выделяться газообразный хлор, а на катоде - металлический натрий.
|
Электролиз - окислительно-восстановительная реакция, которая протекает на электродах при прохождении электрического тока через электролит |
Окислительно-восстановительная реакция, протекающая при электролизе, протекает за счет электрической энергии - без внешнего источника энергии она будет невозможна.
Следует обратить внимание, что электролиз в растворе электролита и электролиз в расплаве электролита - немного разные вещи.
Нюанс заключается в том, что в водном растворе электролита кроме ионов металла и кислотного остатка, присутствуют еще и продукты диссоциации воды, что необходимо учитывать.
Правила электролиза водных растворов

- Электролиз на катоде зависит только от положения металла в электрохимическом ряду напряжений:
- если катион электролита стоит левее алюминия (включительно), на катоде восстанавливается вода с выделением водорода, а катионы металла остаются в растворе:
2H2O+2e- = H2↑+2OH- (Li...Al) - если катион электролита стоит между алюминием и водородом, на катоде восстанавливаются и вода, и катионы металла;
Men++ne- = Me0; 2H2O+2e- = H2↑+2OH- (Mn...Pb) - если катион электролита стоит правее водорода, на катоде восстанавливается только катионы металла:
Men++ne- = Me0 (Cu...Au) - если в растворе электролита находится несколько металлов, первыми восстанавливаются катионы металла, который в ряду напряжений стоит правее остальных.
- если катион электролита стоит левее алюминия (включительно), на катоде восстанавливается вода с выделением водорода, а катионы металла остаются в растворе:
- Электролиз на аноде зависит только от материала, из которого изготовлен анод:
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза - железо, медь, цинк, серебро) - всегда идет процесс окисления металла анода:
Me0-ne- = Men+ - в случае нерастворимого анода (золото, платина, графит):
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
Acm-me- = Ac0 - идет процесс окисления воды в остальных случаях (электролиз оксикислот и фторидов) - анион остается в растворе:
2H2O-4e- = 4H++O2↑ - при электролизе растворов щелочей окисляются гидроксид-ионы:
4OH--4e- = 2H2O+O2↑
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
- восстановительная активность анионов уменьшается в ряду (соответственно увеличивается способность окисляться):
I-; Br-; S2-; Cl-; OH-; SO42-; NO3-; F-
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза - железо, медь, цинк, серебро) - всегда идет процесс окисления металла анода:
Промышленное применение электролиза
- Выделение и очистка металлов.
- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.
Примеры решения задач по электролизу
1. Написать уравнение электролиза раствора хлорида калия для нерастворимого анода.
Решение:
- KCl → K++Cl-
- электрлиз на аноде (+):
2Cl--2e- = Cl20↑ - электролиз на катоде (-):
2H2O+2e- = H2↑+2OH- - Суммарное ионное уравнение:
2H2O+2Cl- = H2↑+Cl2↑+2OH- - Молекулярное уравнение:
2KCl+2H2O = H2↑+Cl2↑+2KOH
2. Написать уравнение электролиза раствора хлорида калия для медного (растворимого) анода.
Решение:
- KCl → K++Cl-
- анод(+):
Cu0-2e- = Cu2+ - ионы меди в процессе электролиза переходят с анода на катод (выделение чистой меди на катоде):
Cu2++2e- = Cu0 - Концентрация хлорида калия в растворе остается постоянной, поэтому, суммарное уравнение электролиза для растворимого анода написать нельзя.
3. Написать уравнение электролиза раствора гидроксида натрия.
Решение:
- NaOH → Na++OH-
- электролиз на аноде(+):
4OH-+4e- = O2↑+2H2O - электролиз на катоде(-):
2H2O+2e- = H2↑+2OH- - Суммарные уравнения:
4H2O+4OH- = 2H2↑+O2↑+4OH-+2H2O
2H2O = 2H2↑+O2↑
4. Написать уравнение электролиза раствора хлорида цинка с угольными электродами.
Решение:
- ZnCl2 → Zn2++2Cl-
- электролиз на аноде(+):
2Cl--2e- = Cl2↑ - катод(-):
Zn2++2e- = Zn0
2H2O+2e- = H2↑+2OH- - Суммарное уравнение электролиза написать нельзя, поскольку, неизвестно сколько электричества затрачивается на восстановление воды, а сколько - на восстновление ионов цинка.
5. Написать уравнение электролиза водного раствора нитратов меди (II) и серебра с нерастворимыми электродами.
Решение:
- Cu(NO3)2 → Cu2++2NO3-
AgNO3 → Ag++NO3- - электролиз на аноде(+):
2H2O-4e- = O2↑+4H+ - электролизы на катоде(-):
Cu2++2e- = Cu0
Ag++e- = Ag0 - Согласно положению металлов в ряду напряжений (см. выше), катионы серебра будут восстанавливаться первыми, катионы меди - в последнюю очередь.
- Ионные уравнения:
4Ag++2H2O = 4Ag0+O2↑+4H+
2Cu2++2H2O = 2Cu0+O2↑+4H+ - Молекулярные уравнения:
4AgNO3+2H2O = 4Ag+O2↑+4HNO3
2Cu(NO3)2+2H2O = 2Cu+O2↑+4HNO3
