Бор (B)

- Обозначение - В (Boron);
- Период - II;
- Группа - 13 (IIIa);
- Атомная масса - 10,811;
- Атомный номер - 5;
- Радиус атома = 98 пм;
- Ковалентный радиус = 82 пм;
- Распределение электронов - 1s22s22p1;
- t плавления = 2075°C;
- t кипения = 3865°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,04/2,01;
- Степень окисления: +3, 0, -3;
- Плотность (н. у.) = 2,34 г/см3 (графит);
- Молярный объем = 4,6 см3/моль.
Первыми бор получили французы Гей-Люссак и Тенар в 1808 году.
В природе элементарный бор не встречается. Почит во всех минералах бор связан с кислородом, он встречается в небольших концентрациях во многих природных соединениях, в виде боратов и боросиликатов, в изверженных и осадочных породах, в водах морей, соляных озер, горячих гейзеров, грязевых вулканов.
Бор в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "5", относится к 13(IIIа) группе (См. Атомы 13(IIIа) группы).
Электронная конфигурация бора - 1s22s22p1 (см. Электронная структура атомов).
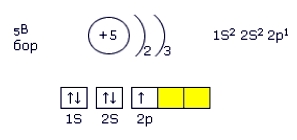
Рис. Электронная конфигурация атома бора.
На внешнем электронном слое бора находятся три электрона, которые он может либо отдавать, либо принимать еще 3, проявляя кислотность +3 или -3.
Бор, как простое вещество
Бор является инертным (при н. у.) неметаллом, образует ряд аллотропных модификаций, отличающихся строением кристаллической решетки - это самое твердное (после алмаза) природное вещество, обладающее малой электропроводностью. Свойства бора во многом зависят от его модификации и чистоты.
Химические свойства бора:
- при комнатной температуре бор вступает в реакцию только со фтором;
- при t=500-700°C реагирует с кислородом, серой, хлором: 4B + 3O2 = 2B2O3;
- при t=1200°C реагинует с кремнием (силицид бора) и азотом (нитрид бора): 3B + Si = B3Si;
- при t=2000°C реагинует с углеродом: 3C + 12B = B12C3;
- в сплавах с металлами бор образует бориды различного состава (в зависимости от условий сплавления и концентрации бора): Ni + 2B = NiB2; 2Ni + B = Ni2B;
- с парами воды бор вступает в реакцию при температуре красного каления: 6H2O + 2B = 2H3BO3 + 3H2.
- взаимодействует с горячими концентрированными азотной и серной кислотой, а также царской водкой: 3HNO3 + B = 3NO2 + H3BO3.
- с кислотами неокислителями бор не реагирует.
Соединения бора
Борная кислота (H3BO3) - это слабая одноосновная кислота, представляет собой растворимое в воде бесцветное кристаллическое вещество.
Борную кислоту получают из минерала сассолина.
Кислотные свойства борной кислоты обусловлены образованием протона при ее взаимодействии с водой:
H3BO3 + H2O = [B(OH)4]- + H+
При нагревании борная кислота, теряя воду, превращается в метаборную кислоту:
H3BO3 → HBO2 → B2O3 + H2O
Борная кислота применяется как дезинфицирующее и антисептическое средство, для изготовления эмалей, специальных стекол, цементов, косметики, средств гигиены.
Борный ангидрид (B2O3) - диэлектрическое бесцветное кристаллическое вещество, легко переходящее в стеклообразное состояние.
Энергично вступает в реакцию с водой, образуя борную кислоту: B2O3 + 3H2O = 2H3BO3.
Получение борного ангидрида:
- обезвоживанием борной кислоты: 2H3BO3 = B2O3 + 3H2O
- нагреванием бора на воздухе (t=700°C): 4B + 3O2 = 2B2O3.
Борный ангидрид нашел применение в производстве специальных стекол и для получения бора.
Получение бора:
- металлотермией получают аморфный "грязый" бор (магний и натрий выступают в роли восстановителей): B2O3 + 3Mg = 2B + 3MgO;
- кристаллический бор высокой частоты получают при температуре 800°C восстановлением галогенидов бора водородом: 2BBr3 + 3H2 = 6HBr + 2B;
- промышленным способом бор получают электролизом расплава K[BF4] и B2O3 (t=800-1000°C).
Применение бора:
- в изготовлении полупроводников (бор - полупроводник p-типа с дырочной проводимостью);
- для изготовления огнеупорных, кислотостойких материалов (силициды устойчивы к действию воды, щелочей, кислот, высокой температуры);
- в качестве металлургических добавок при изготовлении жаропрочной, механически и коррозионноустойчивой стали;
- для изготовления деталей реактивных двигателей, газовых турбин, работающих в тяжелых условиях высоких температур;
- в ядерной энергетике для изготовления замедлителей быстрых нейтронов и для биологической защиты.
