Оксиды Ti, Zr, Hf
- Общие свойства Ti, Zr, Hf
- Получение и применение Ti, Zr, Hf
- Физические и химические свойства
- Соли
- Галогениды
Для металлов 4-й группы наиболее характерными являются диоксиды.
Диоксиды элементов 4-й группы:
- TiO2 (рутил) - минерал (тетрагональная решетка) с температурой плавления 1870°C
- TiO2 (анатаз) - минерал (тетрагональная решетка)
- TiO2 (брукит) - минерал (ромбическая решетка)
- ZrO2 - кубическая решетка, температура плавления 2700°C;
- HfO2 - кубическая решетка, температура плавления 2780°C.
Брукит и анатаз являются низкотемпературными модификациями диоксида титана, при нагревании до 850°С превращаются в рутил, более устойчивый в термодинамическом отношении оксид.
Существуют еще две модификации TiO2 высокого давления: ромбическая (1000°C; 4000 атмосфер) и гексагональная (25000 атмосфер). В лабораторных условиях при давлении в 60000 атмосфер и температуре 1000°C была синтезирована самая твердая модификация TiO2 со структурой типа PbCl2.
Аналогично по три кристаллические модификации (моноклинную, тетрагональную, кубическую) имеют диоксиды ZrO2 и HfO2. Самая устойчивая, моноклинная модификация переходит в тетрагональную с уменьшением объема и увеличением плотности вещества, что при понижении температуры становится причиной возникновения внутренних напряжений, приводящих к растрескиванию больших образцов.
Безводные диоксиды получают прокаливанием кислородсодержащих солей и гидроксидов.
Все диоксиды высокоинертные вещества, что объясняется большой энергией их кристаллической решетки - диоксиды нерастворимы в воде, в растворах кислот (кроме плавиковой) и щелочей. При длительном нагревании вступают в реакцию с концентрированными кислотами:
ZrO2+2H2SO4+(NH4)2SO4 → (NH4)2Zr(SO4)3+2H2O
Способы перевода диоксидов в растворимое состояние:
- сплавление с пиросульфатами:
ZrO2+2K2S2O7 = K2Zr(SO4)3+K2SO4
- сплавление с кислыми фторидами:
ZrO2+4KHF2 = K3[ZrF7]+2H2O+KF
- сплавление с щелочами:
ZrO2+2NaOH = Na2ZrO3+H2O
- хлорирование в присутствии углерода:
ZrO2+2C+2Cl2 = ZrCl4+2CO
Оксиды титана с низкими степенями окисления
- Ti3O5
- Ti2O3
- TiO
Оксиды с низкими степенями окисления получают частичным восстановлением TiO2 водородом или металлическим титаном.
3TiO2+Ti → 2Ti2O3 (1500°C)
Ti2O3 - кристаллы темно-фиолетового цвета, имеют высокую температуру плавления (1830°C), химически инертные, при нагревании диспропорционируют:
Ti2O3 → TiO2+TiO (1800°C)
При более высоких температурах восстановления получают оксиды с меньшим содержанием кислорода:
Ti2O3+Ti → 3TiO (>1500°C)
TiO - кристаллы бронзового цвета, имеют низкую плотность и "рыхлую" структуру типа NaCl, с большим числом "вакансий" атомов кислорода и титана (дефекты Шоттки).
Оксид титана (II) взаимодействует с горячей разбавленной серной кислотой с образованием соединений титана (III) и выделением водорода:
2TiO+3H2SO4 = Ti2(SO4)3+H2↑+2H2O
Низшие оксиды титана Ti6O, Ti3O, Ti2O (с сохраненными связями Ti-Ti) получаются при растворении кислорода в металлическом титане. При нагревании до 300-700°C все низшие оксиды окисляются до диоксида титана.
Низшие оксиды циркония и гафния нестабильны.
Применение оксидов титана и циркония
Оксиды титана и циркония являются важными керамическими материалами.
Мелкодисперсный порошок (размер частиц 20-50 нм) диоксида титана (IV) обладает высокой отражательной способностью и используется как пигмент в производстве красок, называемых "титановыми белилами", а также в производстве пластмасс, синтетических волокон, бумаги, резины, придавая материалам белизну. Титановые белила, в отличие от свинцовых, химически инертны, не токсичны, обладают более высокими качествами.
Кубическая модификация диоксида циркония, стабилизированная незначительным количеством (менее 5 мол.%) Y2O3, обладает высокой прочностью, вязкостью, износостойкостью, термостойкостью и низкой теплопроводностью. Данный материал нашел широкое применение в производстве высокотемпературных химических реакторов, покрытий деталей газотурбинных двигателей, в твердых электролитах в химических источниках тока.
На основе диоксида циркония изготавливают электрохимические датчики для определения парциального давления кислорода, в выхлопных газах автомобилей, измерения поглощения кислорода при дыхании, активности кислорода, растворенного в расплавах металлов, химических источниках тока и проч.
Стабилизированный диоксид циркония также применяют для создания топливных элементов, с высокой удельной энергией и плотностью тока. В таких топливных элементах, изменив полярность, можно менять направление происходящего процесса, например, можно разлагать водяной пар на кислород и водород.
Гидроксиды Ti, Zr, Hf
Гидроксиды металлов 4-й группы нельзя получить из оксидов при их взаимодействии с водой, поскольку такие реакции не протекают по причине химической инертности оксидов титана, циркония и гафния, связанной с очень высокой прочностью их кристаллической решетки.
Структура гидроксида титана формируется в ходе достаточно сложных процессов гидролиза и поликонденсации. Гидроксид титана (титановая кислота) образуется при гидролизе тетрахлорида титана в водном растворе аммиака - контактируя с водой, молекулы TiCl4 повышают координационное число титана до 6, после чего происходит разрыв связей титан-хлор с образованием частиц [Ti(H2O)5(OH)]3+, которые затем поликонденсируются, образуя олигомерные гидроксопроизводные и оксопроизводные:
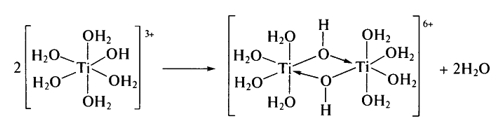
Добавляя по каплям тетрахлорид титана к раствору аммиака в холодной воде, можно получить титановую кислоту в виде геля, содержащего оловые мостики, такую кислоту называют альфа-титановой кислотой - α-TiO2·2H2O. Осаждаясь на холоде, такая кислота очень реакционноспособна по причине большого кол-ва гидроксогрупп.
Альфа-титановая кислота взаимодействует с 60%-й серной кислотой:
TiO2·2H2O+H2SO4 = TiOSO4+3H2O
При подщелачивании солей титана гидроксид титана будет находиться в состоянии коллоидного раствора, поэтому гель не будет образовываться.
С течением времени гидроксильные мостики в осадке титановой кислоты превращаются в оксоловые, происходит, так называемое, старение осадка, называемое оксоляцией. Оксоляции способствуют повышение температуры, увеличение концентрации титановых солей, щелочная среда, длительное время хранения.
α-TiO2·2H2O → β-TiO2·2H2O
В оксоловом полимере бета-титановой кислоты между разными макромолекулами образуются дополнительные связи титан-кислород-титан, поэтому уменьшается число OH-групп и молекул воды, а сам полимер приобретает очень прочное каркасное строение, что обусловливает его химическую инертность - бета-титановая кислота не взаимодействует с растворами кислот и щелочей.
Процесс старения осадка титановой кислоты проходит практически мгновенно, если в растворе присутствуют нитрат-ионы (механизм этой реакции не выяснен). Этого можно добиться в ходе реакции титана с концентрированной азотной кислотой или при нейтрализации щелочью азотнокислых растворов титана, нагретых до 95°C.
Нагревание бета-титановой кислоты приводит к ее дегидратации с образованием рутила - в ходе реакции происходит отщепление молекул воды, а все OH-группы переходят в оксомостики.
Гидроксиды циркония и гафния по своим свойствам сходны с титановыми кислотами - это гелеобразные осадки белого цвета, подверженные старению по причие оксоляции.
Гидроксиды металлов 4-й группы в водных и неводных средах проявляют амфотерный характер, их оснОвные свойства увеличиваются в ряду от титана к гафнию, о чем свидетельствуют минимальные значения pH, которые необходимы для получения осадка гидроксида действием аммиака на солянокислые растворы солей. В зависимости от температуры и концентрации раствора соли:
- при pH=0,5..1,4 осаждается TiO2·xH2O
- при pH=1,9..2,5 осаждается ZrO2·xH2O
- при pH=2,1..2,9 осаждается HfO2·xH2O
