Азот (N)

- Обозначение - N (Nitrogen);
- Период - II;
- Группа - 15 (Va);
- Атомная масса - 14,00674;
- Атомный номер - 7;
- Радиус атома = 92 пм;
- Ковалентный радиус = 75 пм;
- Распределение электронов - 1s22s22p3;
- t плавления = -209,86°C;
- t кипения = -195,8°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 3,04/3,07;
- Степень окисления: +5, +4, +3, +2, +1, 0, -1, -2, -3;
- Плотность (н. у.) = 0,808 г/см3 (-195,8°C);
- Молярный объем = 17,3 см3/моль.
Соединения азота:
Однозначано назвать ученого, который первым открыл азот не представляется возможным по той простой причине, что это практически одновременно сделали в 1772 году сразу трое - Генри Кавендиш, Джозеф Пристли и Даниэль Резерфорд (еще к этому списку можно причислить и Карла Шееле). Однако, ни один из ученых в свое время так и не понял до конца своего открытия. Многие "пальму первенства" отдают шотландцу Даниэлю Резерфорду, поскольку он первым опубликовал магистерскую диссертацию, в которой описал основные свойства "испорченного воздуха".
Собственно название "азот" было предложено в 1787 году А. Лавуазье.
Азот является четвертым самым распространенным химическим элементом Солнечной системы (после водорода, гелия и кислорода). Азот является одним из самых распространенных элементов на Земле:
- в земной атмосфере азота содержится 3,87·1018 кг - 75,6% (по массе) или 78,08% (по объему);
- в земной коре азота содержится (0,7—1,5)·1018 кг;
- в земной мантии азота содержится 1,3·1019 кг;
- в гидросфере азота содержится 2·1016 кг (7·1014 кг в виде соединений).
Азот играет важнейшую роль в жизнедеятельности организмов - он присутствует в белках, аминокислотах, аминах, нуклеиновых кислотах.
Природный азот состоит из двух стабильных изотопов 14N — 99,635% и 15N — 0,365%.
Азот в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "7", относится к 15(Va) группе (См. Атомы 15(Va) группы).
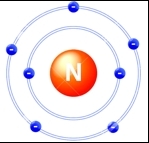
Атом азота содержит 7 электронов, которые располагаются на двух орбиталях (s и p) (см. Электронная структура атомов). На внутренней орбитали расположены 2 электрона; на внешней - 5 (одна свободная электронная пара + три неспаренных электрона, которые могут образовывать три ковалентные связи; см. Ковалентная связь).
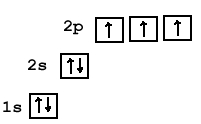
Вступая в реакции с другими химическими элементами, атом азота может проявлять степень окисления от +5 до -3 (кроме трех валентных электронов еще одна связь может образовываться по донорно-акцепторному механизму за счет свободной электронной пары с атомом, имеющим свободную орбиталь).
Степени окисления азота:
- +5 - HNO3;
- +4 - NO2;
- +3 - HNO2;
- +2 - NO;
- +1 - N2O;
- -1 - NH2OH;
- -2 - N2H4;
- -3 (самая распространенная) - NH3.
N2
Три неспаренных р-электрона атома азота, лежащие на его внешнем энергетическом уровне, имеют форму равноплечей восьмерки, располагаясь перпендикулярно друг к другу:
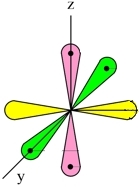
При образовании молекулы азота (N2) p-орбиталь, расположенная по оси X, одного атома, перекрывается с аналогичной px-орбиталью другого атома - в месте пересечения орбиталей образуется повышенная электронная плотность с формирование ковалентной связи (σ-связь).
Две другие орбитали одного атома, расположенные по осям Y и Z, перекрываются боковыми поверхностями со своими "собратьями" другого атома, образуя еще две ковалентные связи (π-связи).
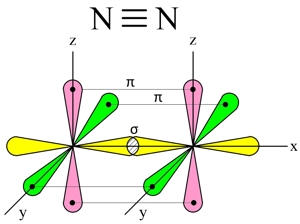
В итоге, в молекуле азота (N2) образуются 3 ковалентные связи (две π-связи + одна σ-связь), т. е., возникает очень прочная тройная связь (см. Множественные связи).
Молекула азота очень прочная (энергия диссоциации 940 кДж/моль), обладает низкой реакционной способностью.
Свойства молекулярного азота
В нормальных условиях азот является малоактивным веществом, что объясняется достаточно прочными межатомарными связями в его молекуле, поскольку образованы они аж тремя парами электронов. По этой причине, обычно азот вступает в реакции при высоких температурах.
Азот:
- газ без запаха и цвета;
- плохо растворим в воде;
- растворим в органических растворителях;
- может реагировать с металлами и неметаллами при нагревании в присутствии катализатора (под воздействием ионизирующего облучения);
- азот вступает в реакции как окислитель (исключение составляют кислород и фтор):
- при нормальных условиях азот реагирует только с литием:
6Li + N2 = 2Li3N; - при нагревании азот реагирует с металлами:
2Al + N2 = 2AlN; - при температуре 500°C и при высоком давлении в присутствии железа азот реагирует с водородом:
N2 + 3H2 ↔ 2NH3; - при температуре 1000°C азот реагирует с кислородом, бором, кремнием:
N2 + O2 ↔ 2NO.
- при нормальных условиях азот реагирует только с литием:
- азот взаимодействует, как восстановитель:
- с кислородом:
N20+O20 ↔ 2N+2O-2 (оксид азота II) - с фтором:
N20+3F20 = 2N+3F3-1 (фторид азота III)
- с кислородом:
Получение и применение азота
Получение азота:
- промышленным способом азот получают сжижением воздуха с последующим отделением азота путем испарения;
- лабораторные способы получения азота:
- разложением нитрита аммония:
NH4NO2 = N2 + 2H2O; - восстановлением азотной кислоты активными металлами:
36HNO3 + 10Fe = 10Fe(NO3)3 + 3N2 + 18H2O; - разложением азидов металлов (чистый азот):
2NaN3 → (t) 2Na + 3N2; - атмосферный азот получают реагированием воздуха с раскаленным коксом:
O2 + 4N2 + 2C → 2CO + 4N2; - пропусканием аммиака над оксидом меди (II) при t=700°C:
2NH3 + 3CuO → N2 + 3H2O + 3Cu.
- разложением нитрита аммония:
Применение азота:
- создание инертных сред в металлургии;
- синтез аммиака и азотной кислоты;
- производство взрывчатых веществ;
- для создания низких температур;
- производство минеральных удобрений: калийная селитра (KNO3); натриевая селитра (NaNO3); аммонийная селитра (NH4NO3); известковая селитра (Ca(NO3)2).
