Фосфор (P)

- Обозначение - P (Phosphorus);
- Период - III;
- Группа - 15 (Va);
- Атомная масса - 30,973761;
- Атомный номер - 15;
- Радиус атома = 128 пм;
- Ковалентный радиус = 106 пм;
- Распределение электронов - 1s22s22p63s23p3;
- t плавления = 44,14°C;
- t кипения = 280°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,19/2,06;
- Степень окисления: +5, +3, +1, 0, -1, -3;
- Плотность (н. у.) = 1,82 г/см3 (белый фосфор);
- Молярный объем = 17,0 см3/моль.
Соединения фосфора:
Фосфор (несущий свет) впервые был получен арабским алхимиком Ахад Бехилем в 12 веке. Из европейских ученых первым открыл фосфор немец Хенниг Брант в 1669 г., во время проведения опытов с человеческой мочой в попытках извлечь из нее золото (ученый полагал, что золотистый цвет мочи вызван присутствием частичек золота). Несколько позже фосфор был получен И. Кункелем и Р. Бойлем - последний описал его в своей статье «Способ приготовления фосфора из человеческой мочи» (14.10.1680; работа была опубликована в 1693 г.). Позже Лавуазье доказал, что фосфор является простым веществом.
Содержание фосфора в земной коре составляет 0,08% по массе - это один из самых распространенных химических элементов на нашей планете. По причине своей высокой активности, фосфор в свободном состоянии в природе не встречается, но входит в состав почти 200 минералов, самыми распространенными из которых являются апатит Ca5(PO4)3(OH) и фосфорит Ca3(PO4)2.
Фосфор играет немаловажную роль в жизни животных, растений и человека - он входит в состав такого биологического соединения, как фосфолипид, также присутствует в белковых и других таких важнейших органических соединениях, как ДНК и АТФ.
Фосфор в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "15", относится к 15(Va) группе (См. Атомы 15(Va) группы).
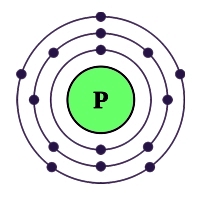
Рис. Строение атома фосфора.
Атом фосфора содержит 15 электронов, и имеет схожую с азотом электронную конфигурацию внешнего валентного уровня (3s23p3), но у фосфора по сравнению с азотом менее выражены неметаллические свойства, что объясняется наличием свободной d-орбитали, большим радиусом атома и меньшей энергией ионизации.
Вступая в реакции с другими химическими элементами, атом фосфора может проявлять степень окисления от +5 до -3 (наиболее характерна степень окисления +5, остальные встречаются достаточно редко).
- +5 - оксид фосфора P2O5(V); фосфорная кислота (H3PO4); фосфаты, галогениды, сульфиды фосфора V (соли фосфорной кислоты);
- +3 - P2O3(III); фосфористая кислота (H3PO3); фосфиты, галогениды, сульфиды фосфора III (соли фосфористой кислоты);
- 0 - P;
- -3 - фосфин PH3; фосфиды металлов.
В основном (невозбужденном) состоянии у атома фосфора на внешнем энергетическом уровне находится два спаренных электрона на s-подуровне + 3 неспаренных электрона на p-орбиталях (d-орбиталь свободна). В возбужденном состоянии один электрон с s-подуровня переходит на d-орбиталь, что расширяет валентные возможности атома фосфора.
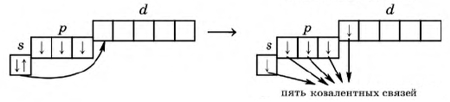
Рис. Переход атома фосфора в возбужденное состояние.
P2
Два атома фосфора объединяются в молекулу P2 при температуре порядка 1000°C.
При более низких температурах фосфор существует в четырехатомных молекулах P4, а также в более устойчивых полимерных молекулах P∞.
Аллотропные модификации фосфора:
- Белый фосфор - чрезвычайно ядовитое (летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г) воскоподобное вещество с запахом чеснока, без цвета, люминисцирующее в темноте (процесс медленного окисления в P4O6); высокая реакционная способность белого фосфора объясняется некрепкими связями Р-Р (у белого фосфора молекулярная кристаллическая решетка с формулой P4, в узлах которой расположены атомы фосфора), которые достаточно легко разрываются, в результате чего белый фосфор при нагревании или в процессе длительного хранения переходит в более устойчивые полимерные модификации: красный и черный фосфор. По этим причинам белый фосфор хранят без доступа воздуха под слоем очищенной воды или в специальных инертных средах.
- Желтый фосфор - огнеопасное, сильно ядовитое вещество, в воде не растворяется, легко окисляется на воздухе и самовозгорается, при этом горит ярко-зеленым ослепительным пламенем с выделением густого белого дыма.
- Красный фосфор - полимерное, нерастворимое в воде вещество со сложной структурой, обладающее наименее реакционной способностью. Красный фосфор широко применяется в промышленном производстве, т. к. не так сильной ядовит. Поскольку на открытом воздухе красный фосфор, впитывая влагу, постепенно окисляется с образованием гигроскопичного оксида ("отсыревает"), образует вязкую фосфорную кислоту, поэтому, красный фосфор хранится в герметически закрытой таре. В случае отмокания красный фосфор очищают от остатков фосфорной кислоты путем промывания водой, затем высушивают и используют по назначению.
- Черный фосфор - жирное на ощупь графитоподобное вещество серо-черного цвета, обладающее полупроводниковыми свойствами - наиболее устойчивая модификация фосфора со средней реакционной способностью.
- Металлический фосфор получают из черного фосфора под высоким давлением. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства фосфора
Из всех аллотропных модификаций фосфора самой активной является белый фосфор (P4). Зачастую в уравнении химических реакций пишут просто P, а не P4. Поскольку, фосфор, как и азот, имеет много вариантов степеней окисления, то в одних реакциях он является окислителем, в других - восстановителем, в зависимости от веществ, с которыми он взаимодействует.
Окислительные свойства фосфор проявляет в реакциях с металлами, которые протекают при нагревании с образованием фосфидов:
3Mg + 2P = Mg3P2.
Фосфор является восстановителем в реакциях:
- с более электроотрицательными неметаллами (кислородом, серой, галогенами):
- соединения фосфора (III) образуются при недостатке окислителя
4P + 3O2 = 2P2O3 - соединения фосфора (V) - при избытке: кислорода (воздуха)
4P + 5O2 = 2P2O5
- соединения фосфора (III) образуются при недостатке окислителя
- с галогенами и серой фосфор образует галогениды и сульфид 3-х или 5-ти валентного фосфора, в зависимости от соотношения реагентов, которые берутся в недостатке или избытке:
- 2P+3Cl2(нед.) = 2PCl3 - хлорид фосфора (III)
- 2P+3S(нед.) = P2S3 - сульфид фосфора (III)
- 2P+5Cl2(изб.) = 2PCl5 - хлорид фосфора (V)
- 2P+5S(изб.) = P2S5 - сульфид фосфора (V)
- с концентрированной серной кислотой:
2P+5H2SO4 = 2H3PO4+5SO2↑+2H2O - с конецнтрированной азотной кислотой:
P+5HNO3 = H3PO4+5NO2↑+H2O - с разбавленной азотной кислотой:
3P+5HNO3+2H2O = 3H3PO4+5NO↑
Фосфор выступает одновременно и окислителем, и восстановителем в реакциях диспропорционирования с водными растворами щелочей при нагревании, образуя (кроме фосфина) гипофосфиты (соли фосфорноватистой кислоты), в которых проявляет нехарактерную для себя степень окисления +1:
4P0+3KOH+3H2O = P-3H3↑+3KH2P+1O2
НАДО ЗАПОМНИТЬ: с другими кислотами, кроме указанных выше реакций, фосфор не реагирует.
Получение и применение фосфора
Промышленным способом фосфор получают путем его восстановления коксом из фосфоритов (фторапататиов), в состав которых входит фосфат кальция, прокаливая в электропечах при температуре 1600°C с добавлением кварцевого песка:
Ca3(PO4)2 + 5C + 3SiO2 = 3CaSiO3 + 2P + 5CO.
На первом этапе реакции под действием высокой температуры оксид кремния (IV) вытесняет оксид фосфора (V) из фосфата:
Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5.
Затем оксид фосфора (V) восстанавливается углём до свободного фосфора:
P2O5+5C = 2P+5CO.
Применение фосфора:
- производство удобрений;
- ядохимикатов;
- спичек;
- моющих средств;
- красок;
- полупроводников.
