Цинк (Zn)

- Обозначение - Zn (Zincum);
- Период - IV;
- Группа - 12 (IIb);
- Атомная масса - 65,39;
- Атомный номер - 30;
- Радиус атома = 138 пм;
- Ковалентный радиус = 125 пм;
- Распределение электронов - 1s22s22p63s23p63d104s2;
- t плавления = 419,88°C;
- t кипения = 907°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,65/1,66;
- Степень окисления: +2, 0;
- Плотность (н. у.) = 7,13 г/см3;
- Молярный объем = 9,2 см3/моль.
Цинк люди использовали еще до нашей эры в виде его сплава с медью - латуни. Впервые чистый цинк удалось выделить англичанину Уильяму Чемпиону в 18 веке.
В земной коре цинка содержится 8,3·10-3% по массе. Много цинка содержится в термальных источниках, из которых происходит осаждение сульфидов цинка, имеющих важное промышленное значение. Цинк играет активную роль в жизни животных и растений, являясь важным биогенным микроэлементом.
Цинк в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "30", относится к переходным металлам (См. Атомы переходных элементов).
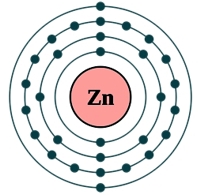
Рис. Строение атома цинка.
Электронная конфигурация атома цинка - 1s22s22p63s23p63d104s2 (см. Электронная структура атомов). Предпоследний электронный слой атома цинка полностью заполнен, а на внешнем слое находится два s-электрона, которые и взаимодействуют с другими элементами, поэтому в соединениях цинк проявляется степень окисления +2. (см. Валентность). Цинк обладает высокой химической активностью.
Физические свойства цинка:
- голубовато-белый металл;
- хрупкий при н. у.;
- при нагревании более 100°C хорошо куется и прокатывается;
- обладает хорошей тепло- и электропроводностью.
Химические свойства цинка:
- на воздухе быстро окисляется, покрываясь тонкой пленкой оксида цинка, предохраняющей металл от дальнейшей реакции;
- при нагревании реагирует с кислородом, хлором, серой, образуя оксиды, хлориды, сульфиды соответственно:
2Zn + O2 = 2ZnO; Zn + Cl2 = ZnCl2; Zn + S = ZnS. - реагирует с разбавленной серной кислотой и растворами кислот неокислителей, вытесняя из них водород:
Zn + H2SO4(рзб.) = ZnSO4 + H2; Zn + 2HCl = ZnCl2 + H2; - реагирует с азотной и концентрированной серной кислотой, восстанавливая азот или серу соответственно:
Zn + H2SO4(кнц.) = ZnSO4 + SO2 + 2H2O; - реагирует при нагревании с растворами щелочей, образуя гидроцинкаты: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2;
- вытесняет менее активные металлы (см. электрохимический ряд напряжений металлов) из растворов их солей: Zn + CuCl2 = ZnCl2 + Cu.
Получение цинка:
- чистый цинк получают электролизом его солей;
- промышленным способом цинк получают из сульфидных руд:
- на первом этапе получают оксид цинка, подвергая руду окислительному обжигу: 2ZnS + 3O2 = 2ZnO + 2SO2;
- на втором этапе оксид цинка восстанавливают углем при высокой температуре: ZnO + C = Zn + CO.
Применение цинка:
- в качестве антикоррозионного покрытия металлических изделий (цинкование);
- для изготовления сплавов, широко применяющихся в машиностроении;
- в АКБ и сухих элементах;
- в лакокрасочной промышленности (изготовление цинковых белил);
- как восстановитель в реакциях органического синтеза.
