Ртуть (Hg)

- Обозначение - Hg (Hydrargyrum);
- Период - VI;
- Группа - 12 (IIb);
- Атомная масса - 200,59;
- Атомный номер - 80;
- Радиус атома = 157 пм;
- Ковалентный радиус = 149 пм;
- Распределение электронов - 1s22s22p63s23p63d104s24p64d104f145s25p65d106s2;
- t плавления = -38,86°C;
- t кипения = 356,6°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,9/1,5;
- Степень окисления: +2, +1;
- Плотность (н. у.) = 13,546 г/см3;
- Молярный объем = 14,81 см3/моль.
Ртуть для очистки золота использовали еще древние греки и римляне. Чистую ртуть впервые в 1735 году выделил швед Георг Брандт, ее принадлежность к металлам была доказана М. В. Ломоносовым в 1759 году, когда российский ученый совместно с Брауном заморозил ртуть и установил ее металлические свойства.
Ртуть является единственным металлом, который находится в жидком состоянии при нормальных условиях.
Ртуть относится к группе редкоземельных металлов (содержание ртути в земной коре 7·10-6%), однако, несмотря на это, ртутные руды бывают достаточно концентрированными (до 2,5%) по причине слабого связывания этого металла с другими элементами. 99,98% всей природной ртути находится в рассеянной форме, и только 0,02% - в месторождениях. Современная наука знает порядка 30 ртутьсодержащих минералов, основным из которых является кноварь HgS.
Ртуть в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "80", относится к переходным металлам (См. Атомы переходных элементов).
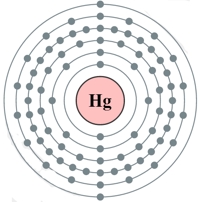
Рис. Строение атома ртути.
Электронная конфигурация атома ртути - 1s22s22p63s23p63d104s24p64d104f145s25p65d106s2 (см. Электронная структура атомов). Как и у цинка, предпоследний электронный слой атома ртути полностью заполнен, а на внешнем слое находится два s-электрона. Однако, в отличие от цинка, ртуть в соединениях может проявлять степень окисления не только +2, но и +1.
| II | I |
| HgO | Hg2O |
| HgCl2 | Hg2Cl2 |
| Hg(NO2)2 | Hg2(NO2)2 |
Ртуть является чрезвычайно токсичным веществом, может вызывать сильное отравление, поскольку, попадая внутрь организма человека вызывает агглютинацию эритроцитов и ингибирование ферментов, что объясняется реагированием ртути с сульфидными группами -SH, которые входят в состав различных белков, аминокислот и ферментов.
Физические свойства ртути:
- при н. у. жидкий металл серебристо-серого цвета;
- диамагнетик;
- со многими металлами образует сплавы, называемые амальгамой.
Химические свойства ртути:
- реагирует с простыми веществами: кислородом, серой, селеном, теллуром, галогенами: 2Hg + O2 = 2HgO; Hg + S = HgS;
- не взаимодействует с N2, P2, Si2, C2;
- реагирует при нагревании с "царской водкой", азотной, концентрированной серной кислотой, образуя нитрат ртути (II):
Hg + 4HNO3(кнц.) = Hg(NO3)2 + 2NO2 + 2H2O; - без нагревания реагирует с азотной кислотой, образуя нитрат ртути (I): 6Hg + 8HNO3(рзб.) = 3Hg2(NO3)2 + 2NO + 4H2O;
- не реагирует со щелочами, разбавленной серной и хлористоводородной кислотами.
Получение ртути:
- чистую ртуть получают электрохимическим рафинированием;
- промышленным способом ртуть получают обжигом руды HgS при высокой температуре (700°C): HgS + O2 = Hg + SO2.
Применение ртути:
- в барометрах, манометрах, термометрах, вакуумных насосах и проч.;
- в ртутных лампах, выпрямителях, переключателях;
- для амальгамации серебра и золота в металлургических процессах;
- в качестве жидкого катода при производстве едких щелочей;
- как катализатор в реакциях синтеза уксусной кислоты;
- как компонент краски морских судов;
- в качестве протравителя семян и гербицида в сельском хозяйстве.
