Золото (Au)

- Обозначение - Au (Aurum);
- Период - VI;
- Группа - 11 (Ib);
- Атомная масса - 196,96655;
- Атомный номер - 79;
- Радиус атома = 144 пм;
- Ковалентный радиус = 134 пм;
- Распределение электронов - 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1;
- t плавления = 1064,18°C;
- t кипения = 2856°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,54/1,42;
- Степень окисления: +5, +3, +1, -1;
- Плотность (н. у.) = 19,3 г/см3;
- Молярный объем = 10,2 см3/моль.
Золото является одним из самых "необычных" металлов, известных человеку с давних пор - наши предки использовали золото по большей части в культурно-религиозных целях, а также в качестве одного из самых надежных платежных средств.
Золото в природе встречается в подавляющем большинстве случаев в виде самородков. С некоторыми металлами золото может образовывать природные твердые растворы:
- электрум - серебристое золото;
- аурокуприд - меднистое золото;
- платинистое золото.
В виде соединений золото в природе встречается гораздо реже (калагерит AuTe2, ауростибит AuSb2). Достаточно много золота содержится в морской воде, но добыча такого золота нерентабельна.
Золото в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "79", относится к переходным металлам (См. Атомы переходных элементов).
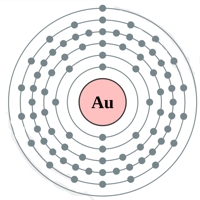
Рис. Строение атома золота.
Электронная конфигурация атома золота - 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1 (см. Электронная структура атомов). Золото является одним из самых малоактивных химических элементов - оно не окисляется на воздухе даже в присутствии влаги, не взаимодействует непосредственно с кислородом, водородом, азотом, углеродом, фосфором.
Физические свойства золота:
- золотисто-желтый металл;
- очень пластичный и мягкий - можно раскатать в прозрачную фольгу толщиной несколько микрон (сусальное золото), которой покрывать разнообразные художественные и религиозные изделия (производить золочение), придавая им эстетический привлекательный вид, который сохраняется длительное время;
- обладает хорошей электро- и теплопроводностью.
Химические свойства золота:
- реагирует с галогенами при нагревании: 2Au + 3Cl2 = 2AuCl3;
- не растворяется в щелочных и кислотных растворах;
- растворяется в смесях кислот: HCl+HNO3 (царской водке) и H2SO4+HNO3: Au + 3HNO3 + 3HCl = AuCl3 + 3NO2 + 3H2O;
- металлическое золото переходит в раствор в виде комплексной соли в водных растворах цианида калия и натрия в присутствии окислителей: 4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4KOH;
- легко растворяется в ртути с образованием сплава (амальгамы).
Кислородные соединения золота при незначительном нагревании легко разлагаются со взрывом, например, гремучее золото взрывается при 145°C.
Соединения золота достаточно легко гидролизуются и восстанавливаются до свободного металла в водных растворах, поскольку являются неустойчивыми соединениями: при нагревании гидроксид золота (III) дегидратируется образуя оксид золота (III), который, в свою очередь, распадается с образованием свободного золота при 160°C: 4Au(OH)3 → 2Au2O3 → 4Au + 3O2.
Гидроксид и оксид золота (III) - амфотерные соединения, реагируют с кислотами и основаниями, образуя комплексные соединения:
- Au(OH)3 + KOH = K[Au(OH)4]
- Au(OH)3 + 4HCl = H[AuCl4] + 3H2O
Применение золота:
- в ювелирном деле;
- как международное платежное средство;
- в электротехнике для золочения контактов;
- для нанесения покрытий на металлические поверхности;
- в медицине для изготовления инструментов и протезов;
- как катализатор при проведении некоторых реакций в химической промышленности;
- радиоактивный изотоп золота применяют в онкологии для лечения новообразований.
