Кислородсодержащие соединения галогенов
Галогены могут вступать в реакцию с кислородом при этом образуются неустойчивые соединения.
Из кислородсодержащих соединений галогенов наиболее устойчивыми являются соли кислородсодержащих кислот.
Галогены (за исключением фтора) во всех кислородсодержащих соединениях проявляют положительные степени окисления +7, +5, +3, +1.
Наиболее значимыми являются кислородные кислоты хлора и их соли:
- Кислотный оксид: Cl2+1O
- Хлорноватистая кислота: HClO
- Пример соли: гипохлорит натрия NaClO
- Графическая формула:
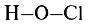
- Кислотный оксид: Cl2+3O3
- Хлористая кислота: HClO2
- Пример соли: хлорит кальция Ca(ClO2)2
- Графическая формула:
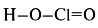
- Кислотный оксид: Cl2+5O5
- Хлорноватая кислота: HClO3
- Пример соли: хлорит магния Mg(ClO3)2
- Графическая формула:
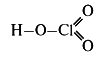
- Кислотный оксид: Cl2+7O7
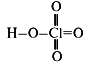
- Хлорная кислота: HClO4
- Пример соли: перхлорат калия KClO4
- Графическая формула:
Кислотные свойства усиливаются сверху вниз - от хлорноватистой кислоты до хлорной.
Кислородные кислоты галогенов гораздо менее устойчивы, нежели их соли.
| степень окисления | +1 | +3 | +5 | +7 |
|---|---|---|---|---|
| Кислота | HClO | HClO2 | HClO3 | HClO4 |
| Кислота | HBrO | HBrO2 | HBrO3 | HBrO4 |
| Кислота | HIO | HIO2 | HIO3 | H5IO6 |
Кислотные свойства кислородсодержащих кислот галогенов, представленных в таблице, увеличиваются слева-направо и снизу-вверх: HIO, HBrO, HClO - слабые кислоты; HClO4, HBrO4 - сильные кислоты.
HClO3+KOH = KClO3+H2O
Окислительная активность кислот увеличивается справа-налево и снизу-вверх: H5IO6 - является слабым окислителем; HClO - сильный окислитель.
NaI-1 + 3HCl+1O = NaI+5O3 + 3HCl-1
Неустойчивые кислоты разлагаются при комнатной температуре:
2HClO = O2+2HCl NaClO2 = O2+NaCl
или при нагревании:
2KClO3 = 3O2+2KCl
Получение и применение
Получение хлорноватистой кислоты:
- растворением хлора в воде:
Cl2+H2O = HCl+HClO
- вытеснением этой кислоты из ее соли более сильной кислотой:
NaClO+H2CO3 = NaHCO3+HClO
Хлорноватую и хлорную кислоты получают также путем вытеснения из соли более сильной кислотой:
Ba(ClO3)2+H2SO4 = BaSO4↓+2HClO3 KClO4+H2SO4 = HClO4+KHSO4
Применение кислородсодержащих соединений галогенов:
- гипохлорит калия (KClO) и натрия (NaClO) применяют в качестве отбеливателя тканей и бумаги, дезинфицирующего средства сточных вод;
- хлораты (KClO3) применяют в целлюлозно-бумажной промышленности для получения ClO2, в производстве спичек, в пиротехнике;
- хлорная кислота применяется в аналитической химии в качестве растворителя металлов, как стандарт в ацидометрии;
- перхлораты нашли широкое применение как твердые кислородоносители в химических источниках кислорода, в пиротехнике.
См. далее:
