Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) - сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) - серный ангидрид
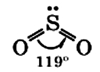
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде - при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
SO2+NaOH = NaHSO3 - гидросульфит натрия SO2+2NaOH = Na2SO3+H2O - сульфит натрия
- реакции сернистого газа с основными оксидами:
SO2+CaO = CaSO3 SO2+K2O = K2SO3
- с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
H2O+SO2 ↔ H2SO3
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона - на второй:
H2SO3 ↔ H++HSO3- HSO3- ↔ H++SO32-
- пример реакции сернистой кислоты в качестве восстановителя:
2H2SO3+O2 = 2H2SO4
- пример реакции сернистой кислоты в качестве окислителя:
H2SO3+2H2S = 3S+3H2O
Сернистая кислота может образовывать средние соли (сульфиты) - Na2SO3, и кислые соли (гидросульфиты) - NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
S+4O2+2H2S-2 = 3S0↓+2H2O
- в реакции с кислородом при нагревании сернистый газ является восстановителем:
2S+4O2+O20 = 2S+6O3-2
Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
S+O2 = SO2 4Fe+2S2-1+11O20 = 2Fe2+3O3-2+8S+4O2
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
2HCl+Na2SO3 = 2NaCl+SO2↑+H2O Cu+2H2SO4(конц.) = CuSO4+SO2↑+2H2O
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
