Хром (Cr)

- Обозначение - Cr (Chromium);
- Период - IV;
- Группа - 6 (VIb);
- Атомная масса - 51,9961;
- Атомный номер - 24;
- Радиус атома = 130 пм;
- Ковалентный радиус = 118 пм;
- Распределение электронов - 1s22s22p63s23p63d54s1;
- t плавления = 1857°C;
- t кипения = 2672°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,66/1,56;
- Степень окисления: +6, +3, +2, 0;
- Плотность (н. у.) = 7,19 г/см3;
- Молярный объем = 7,23 см3/моль.
Хром (цвет, краска) впервые был найден на Березовском золоторудном месторождении (Средний Урал), первые упоминания относятся к 1763 году, в своем труде "Первые основания металлургии" М. В. Ломоносов называет его "красной свинцовой рудой".
Массовое содержание хрома в земной коре составляет 0,02% (распространенный элемент). Чаще всего хром в природе присутствует в соединениях хромита FeCrO4 и крокоита PbCrO4.
Хром в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "24", относится к 6(VIb) группе (см. Атомы 6(VIb) группы), является переходным металлом (См. Атомы переходных элементов).
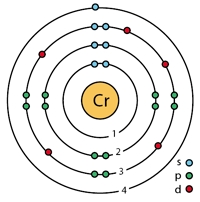
Рис. Строение атома хрома.
Электронная конфигурация атома хрома - 1s22s22p63s23p63d54s1 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 1 электрон, находящийся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 6 электронов), поэтому в соединениях хром может принимать степени окисления от +6 до +1 (наиболее часто встречаются +6, +3, +2). Хром является химически малоактивным металлом, с простыми веществами вступает в реакцию только при высоких температурах.
Физические свойства хрома:
- металл голубовато-белого цвета;
- очень твердый металл (в присутствии примесей);
- хрупкий при н. у.;
- пластичный (в чистом виде).
Химические свойства хрома
- при t=300°C реагирует с кислородом:
4Cr + 3O2 = 2Cr2O3; - при t>300°C реагирует с галогенами, образуя смеси галогенидов;
- при t>400°C реагирует с серой, с образованием сульфидов:
Cr + S = CrS; - при t=1000°C тонкоизмельченный хром реагирует с азотом, образуя нитрид хрома (полупроводник, обладающий высокой химической устойчивостью):
2Cr + N2 = 2CrN; - реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Cr + 2HCl = CrCl2 + H2;
Cr + H2SO4 = CrSO4 + H2; - теплые концентрированные азотная и серная кислоты растворяют хром.
С концентрированными серной и азотной кислотой при н.у. хром не взаимодействует, также не растворяется хром и в царской водке, примечательно, что чистый хром не вступает в реакцию даже с разбавленной серной кислотой, причина этого феномена до сих пор не установлена. При длительном хранении в концентрированной азотной кислоте хром покрывается очень плотной оксидной пленкой (пассивируется), и перестает реагировать с разбавленными кислотами.
Соединения хрома
Выше уже было сказано, что "любимыми" степенями окисления хрома являются +2 (CrO, Cr(OH)2), +3 (Cr2O3, Cr(OH)3), +6 (CrO3, H2CrO4).
Хром является хромофором, т.е., элементом, придающим окраску веществу, в котором он содержится. Например, в степени окисления +3, хром придает лилово-красную или зеленую окраску (рубин, шпинель, изумруд, гранат); в степени окисления +6 - желто-оранжевую окраску (крокоит).
Хромофорами, кроме хрома, являются также железо, никель, титан, ванадий, марганец, кобальт, медь - всё это d-элементы.
Цвет распространенных соединений, в состав которых входит хром:
- хром в степени окисления +2:
- оксид хрома CrO - красный;
- фторид хрома CrF2 - сине-зеленый;
- хлорид хрома CrCl2 - не имеет цвета;
- бромид хрома CrBr2 - не имеет цвета;
- йодид хрома CrI2 - красно-коричневый.
- хром в степени окисления +3:
- Cr2O3 - зеленый;
- CrF3 - светло-зеленый;
- CrCl3 - фиолетово-красный;
- CrBr3 - темно-зеленый;
- CrI3 - черный.
- хром в степени окисления +6:
- CrO3 - красный;
- хромат калия K2CrO4 - лимонно-желтый;
- хромат аммония (NH4)2CrO4 - золотисто-желтый;
- хромат кальция CaCrO4 - желтый;
- хромат свинца PbCrO4 - светло-коричнево-желтый.
Оксиды хрома:
Гидроксиды хрома:
С увеличением степени окисления хрома в оксидах и гидроксидах происходит ослабление основных и усиление кислотных их свойств.
Получение хрома
Как было указано выше, основным источником хрома являются хромсодержащие руды: хромит и крокоит.
Оксид хрома (III) Cr2O3, который необходим для получения металлического хрома, получают в несколько этапов:
- на первом этапе обжигом руды с карбонатом натрия нерастворимый хромат железа переводят в растворимый хромат натрия:
Na2Cr2O7 + 3C = Na2O + Cr2O3 + 3CO; - металлический хром получаеют восстанавливая оксид хрома (III) алюминием (кремнием):
Cr2O3 + 2Al = 2Cr + Al2O3.
Более подробно технология получения хрома описана на странице "Получение и применение Cr, Mo, W".
Применение хрома
- как лигирующая добавка при выплавке жаростойких и коррозионностойких слпавов;
- для хромирования металлических изделий с целью придания им высокой коррозионной стойкости, устойчивости к истиранию и красивого внешнего вида;
- сплавы хром-30 и хром-90 используются в соплах плазмотронов и в авиационной промышленности.
