Кремний (Si)

- Обозначение - Si (Silicon);
- Период - III;
- Группа - 14 (IVa);
- Атомная масса - 28,0855;
- Атомный номер - 14;
- Радиус атома = 132 пм;
- Ковалентный радиус = 111 пм;
- Распределение электронов - 1s22s22p63s23p2;
- t плавления = 1412°C;
- t кипения = 2355°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,90/1,74;
- Степень окисления: +4, +2, 0, -4;
- Плотность (н. у.) = 2,33 г/см3;
- Молярный объем = 12,1 см3/моль.
Соединения кремния:
В чистом виде впервые кремний был выделен в 1811 году (французы Ж. Л. Гей-Люссак и Л. Ж. Тенар). Чистый элементарный кремний был получен в 1825 г. (швед Й. Я. Берцелиус). Свое название "кремний" (в переводе с древнегреческого - гора) химический элемент получил в 1834 году (российский химик Г. И. Гесс).
Кремний является самым распространенным (после кислорода) химическим элементом на Земле (содержание в земной коре 28-29% по массе). В природе кремний чаще всего присутствует в виде кремнезема (песок, кварц, кремень, полевые шпаты), а также в силикатах и алюмосиликатах. В чистом виде кремний встречается чрезвычайно редко. Многие природные силикаты в чистом виде являются драгоценными камнями: изумруд, топаз, аквамари - это все кремний. Чистый кристаллический оксид кремния (IV) встречается в виде горного хрусталя и кварца. Оксид кремния, в котором присутствуют различные примеси, образует драгоценные и полудрагоценные камни - аметист, агат, яшма.
Кремний в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "14", относится к 14(IVa) группе (См. Атомы 14(IVa) группы).
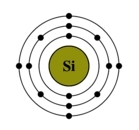
Рис. Строение атома кремния.
Электронная конфигурация кремния - 1s22s22p63s23p2 (см. Электронная структура атомов). На внешнем энергетическом уровне у кремния находятся 4 электрона: 2 спаренных на 3s-подуровне + 2 неспаренных на p-орбиталях. При переходе атома кремния в возбужденное состояние один электрон с s-подуровня "покидает" свою пару и переходит на p-подуровень, где имеется одна свободная орбиталь. Т. о., в возбужденном состоянии электронная конфигурация атома кремния приобретает следующий вид: 1s22s22p63s13p3.
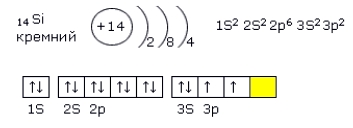
Рис. Переход атома кремния в возбужденное состояние.
Т. о., кремний в соединениях может проявлять валентность 4 (чаще всего) или 2 (см. Валентность). Кремний (так же, как и углерод), реагируя с другими элементами, образует химические связи в которых может как отдавать свои электроны, так и принимать их, но при этом способность принимать электроны у атомов кремния выражена слабее, чем у атомов углерода, по причине большего размера атома кремния.
Степени окисления кремния:
- -4: SiH4 (силан), Ca2Si, Mg2Si (силикаты металлов);
- +4 - наиболее устойчивая: SiO2 (оксид кремния), H2SiO3 (кремниевая кислота), силикаты и галогениды кремния;
- 0: Si (простое вещество)
Кремний, как простое вещество
Кремний представляет из себя темно-серое кристаллическое вещество с металлическим блеском. Кристаллический кремний является полупроводником.
Кремний образует только одну аллотропную модификацию, подобную алмазу, но при этом не такую прочную, т. к. связи Si-Si не так прочны, как в алмазной молекуле углерода (См. Алмаз).
Аморфный кремний - порошок бурого цвета, с температурой плавления 1420°C.
Кристаллический кремний получают из аморфного путем его перекристаллизации. В отличие от аморфного кремния, который является достаточно активным химическим веществом, кристаллический кремний более инертен в плане взаимодействия с другими веществами.
Строение кристаллической решетки кремния повторяет структуру алмаза, - каждый атом окружен четырьмя другими атомами, расположенными в вершинах тетраэдра. Атомы связываются друг с другом ковалентными связями, которые не так прочны, как углеродные связи в алмазе. По этой причине, даже при н.у. некоторые ковалентные связи в кристаллическом кремнии разрушаются, в результате чего высвобождается некоторая часть электронов, благодаря чему кремний обладает небольшой электропроводностью. По мере нагревания кремния, на свету или при добавлении некоторых примесей, кол-во разрушаемых ковалентных связей увеличивается, вследствие чего и увеличивается кол-во свободных электронов, следовательно, растет и электропроводность кремния.
Химические свойства кремния
Как и углерод, кремний может быть и восстановителем, и окислителем, в зависимости от того, с каким веществом вступает в реакцию.
При н.у. кремний взаимодействует только с фтором, что объясняется достаточно прочной кристаллической решеткой кремния.
В реакцию с хлором и бромом кремний вступает при температурах, превышающих 400°C.
С углеродом и азотом кремний взаимодействует только при очень высоких температурах.
- В реакциях с неметаллами кремний выступает в роли восстановителя:
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
Si + 2F2 = SiF4 - при высоких температурах кремний реагирует с хлором (400°C), кислородом (600°C), азотом (1000°C), углеродом (2000°C):
- Si + 2Cl2 = SiCl4 - галогенид кремния;
- Si + O2 = SiO2 - оксид кремния;
- 3Si + 2N2 = Si3N4 - нитрид кремния;
- Si + C = SiC - карборунд (карбид кремния)
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
- В реакциях с металлами кремний является окислителем (образуются салициды:
Si + 2Mg = Mg2Si - В реакциях с концентрированными р-рами щелочей кремний реагирует с выделением водорода, образуя растворимые соли кремниевой кислоты, называемые силикатами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑ - С кислотами (за исключением HF) кремний не реагирует.
Получение и применение кремния
Получение кремния:
- в лаборатории - из кремнезема (алюмотерапия):
3SiO2 + 4Al = 3Si + 2Al2O3 - в промышленности - восстановлением оксида кремния коксом (технически чистый кремний) при высокой температуре:
SiO2 + 2C = Si + 2CO - самый чистый кремний получают восстановлением тетрахлорида кремния водородом (цинком) при высокой температуре:
SiCl4+2H2 = Si+4HCl
Применение кремния:
- изготовление полупроводниковых радиоэлементов;
- в качестве металлургических добавок при производстве жаропрочных и кислотоустойчивых соединений;
- в производстве фотоэлементов для солнечных батарей;
- в качестве выпрямителей переменного тока.
