Марганец (Mn)

- Обозначение - Mn (Manganese);
- Период - IV;
- Группа - 7 (VIIb);
- Атомная масса - 54,938046;
- Атомный номер - 25;
- Радиус атома = 127 пм;
- Ковалентный радиус = 117 пм;
- Распределение электронов - 1s22s22p63s23p63d54s2;
- t плавления = 1244°C;
- t кипения = 1962°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,55/1,60;
- Степень окисления: +7, +6, +5, +4, +3, +2, +1, 0;
- Плотность (н. у.) = 7,21 г/см3;
- Молярный объем = 7,35 см3/моль.
Соединения марганца:
- Оксид марганца MnO(II)
- Гидроксид марганца Mn(OH)2(II)
- Оксид марганца MnO2(IV)
- Оксид марганца Mn2O7(VII)
- Соли марганца
- Марганцовая кислота
Пиролюзит(минерал марганца) был известен людям еще с древних времен, он использовался нашими предками для осветления стекла, получаемого варкой. До 1774 г. пиролюзит считали разновидностью магнитного железняка. И только в 1774 г. швед К. Шееле догадался, что в пиролюзите присутствует неизвестный тогдашней науке металл, после чего Ю. Ган получил металлический марганец, нагревая пиролюзит в печке с углем. Свое название "марганец" получил в начале 19 века (от немецкого Manganerz — марганцевая руда).
Марганец занимает 14-е место среди всех химических элементов по распространенности в земной коре. Больше всего марганца содержится в основных породах. Самостоятельные месторождения марганца крайне редки, чаще этот металл сопутствует железу во многих его рудах. Достаточно много марганца содержится в железо-марганцевых конкрециях, расположенных в донной части Мирового океана.
Минералы, богатые марганцем:
- пиролюзит - MnO2·nH2O
- манганит - MnO(OH)
- марганцевый шпат - MnCO3
- браунит - 3Mn2O3·MnSiO3
Марганец в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "25", относится к переходным металлам (См. Атомы переходных элементов).
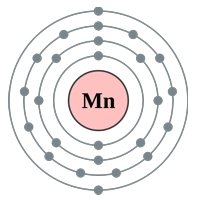
Рис. Строение атома марганца.
Электронная конфигурация атома марганца - 1s22s22p63s23p63d54s2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 7 электронов), поэтому в соединениях марганец может принимать степени окисления от +7 до +1 (наиболее часто встречаются +7, +2). Марганец является химически активным металлом. Аналогично алюминию при комнатной температуре реагирует с кислордом, содержащимся в атмосферном воздухе, с образованием прочной защитной оксидной пленки, которая предотвращает дальнейшее окисление металла.
Физические свойства марганца:
- металл серебристо-белого цвета;
- твердый;
- хрупкий при н. у.
Известны 4 модификации марганца: α-форма; β-форма; γ-форма; δ-форма.
До 710°C устойчивой является α-форма, которая при дальнейшем нагревании последовательно через все модификации переходит к δ-форме (1137°C).
Химические свойства марганца
- марганец (порошок) легко реагирует с кислородом, образуя оксиды, вид которого зависит от температуры реакции:
- 450°C - MnO2;
- 600°C - Mn2O3;
- 950°C - Mn3O4;
- 1300°C - MnO.
- мелкораздробленный марганец при нагревании реагирует с водой с выделением водорода:
Mn + 2H2O = Mn(OH)2 + H2; - марганец (порошок) при нагревании вступает в реакцию с азотом, углеродом, серой, фосфором:
Mn + S = MnS; - активно реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Mn + 2HCl = MnCl2 + H2; - реагирует с разбавленной азотной кислотой:
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
Применение и получение марганца
Получение марганца:
- чистый марганец получают электролизом водных растворов MnSO4 с добавкой (NH4)2SO4 при pH=8-8,5: анод - свинец; катод - нержавеющая сталь (чешуйки марганца снимают с катодов);
- менее чистый марганец получают из его оксидов металлотермическими методами:
- алюмотермия:
4Al + 3MnO2 = 3Mn + 2Al2O3; - кремнийтермия:
Si + MnO2 = Mn + SiO2.
- алюмотермия:
Применение марганца:
- в металлургии марганец используют для связывания серы и кислорода:
Mn + S = MnS; 2Mn + O2 = 2MnO; - в качестве лигирующей добавки при выплавке различных сплавов (марганец дает коррозоустойчивость, вязкость, твердость):
- манганин - сплав марганца с медью и никелем;
- ферромарганец - сплав марганца с железом;
- марганцевая бронза - сплав марганца с медью.
- Калия перманганат издавная используют в качестве антисепитческого средства, которое действует только на поверхности кожи и слизистых оболочек.
Биологическая роль марганца:
Марганец входит в десятку "металлов жизни", необходимых для нормальной жизнедеятельности животных и растительных клеток.
В теле взрослого человека содержится порядка 12 мг марганца, который участвует в образовании белковых комплексов, а также входит в состав некоторых нуклеиновых кислот, аминокислот, ферментов (аргиназы и холинэстеразы).
Марганец наряду с магнием участвует в активации гидролиза АТФ, обеспечивая тем самым энергетическую жизнедеятельность живой клетки.
Ионы марганца участвуют в активации нуклеазы - данный фермент необходим для разложения нуклеиновых кислот до нуклеотидов.
