Углерод (C)

- Обозначение - C (Carbon);
- Период - II;
- Группа - 14 (IVa);
- Атомная масса - 12,011;
- Атомный номер - 6;
- Радиус атома = 77 пм;
- Ковалентный радиус = 77 пм;
- Распределение электронов - 1s22s22p2;
- t плавления = 3550°C;
- t кипения = 4827°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,55/2,50;
- Степень окисления: +4, +3, +2, +1, 0, -1, -2, -3, -4;
- Плотность (н. у.) = 2,25 г/см3 (графит);
- Молярный объем = 5,3 см3/моль.
Углерод в виде древесного угля известен человеку с незапамятных времен, поэтому, о дате его открытия говорить не имеет смысла. Собственно свое название "углерод" получил в 1787 году, когда была опубликована книга "Метод химической номенклатуры", в которой вместо французского названия «чистый уголь» (charbone pur) появился термин «углерод» (carbone).
Углерод обладает уникальной способностью образовывать полимерные цепочки неограниченной длины, порождая тем самым огромный класс соединений, изучением которых занимается отдельный раздел химии - органическая химия. Органические соединения углерода лежат в основе земной жизни, поэтому, о важности углерода, как химического элемента, говорить не имеет смысла - он основа жизни на Земле.
Сейчас рассмотрим углерод с точки зрения неорганической химии.
Углерод в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "6", относится к 14(IVa) группе (См. Атомы 14(IVa) группы).
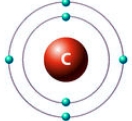
Рис. Строение атома углерода.
Электронная конфигурация углерода - 1s22s22p2 (см. Электронная структура атомов). На внешнем энергетическом уровне у углерода находятся 4 электрона: 2 спаренных на s-подуровне + 2 неспаренных на p-орбиталях. При переходе атома углерода в возбужденное состояние (требует энергетических затрат) один электрон с s-подуровня "покидает" свою пару и переходит на p-подуровень, где имеется одна свободная орбиталь. Т. о., в возбужденном состоянии электронная конфигурация атома углерода приобретает следующий вид: 1s22s12p3.
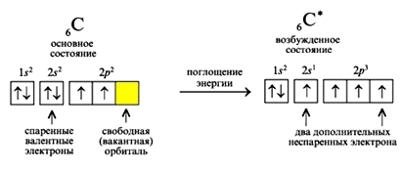
Рис. Переход атома углерода в возбужденное состояние.
Такая "рокировка" существенно расширяет валентные возможности атомов углерода, которые могут принимать степень окисления от +4 (в соединениях с активными неметаллами) до -4 (в соединениях с металлами).
В невозбужденном состоянии атом углерода в соединениях имеет валентность 2, например, CO(II), а в возбужденном - 4: CO2(IV).
"Уникальность" атома углерода заключается в том, что на его внешнем энергетическом уровне находятся 4 электрона, поэтому, для завершения уровня (к чему, собственно, стремятся атомы любого химического элемента) он может с одинаковым "успехом", как отдавать, так и присоединять электроны с образованием ковалентных связей (см. Ковалентная связь).
Углерод, как простое вещество
Как простое вещество углерод может находиться в виде нескольких аллотропных модификаций:
- Алмаз
- Графит
- Фуллерен
- Карбин
Алмаз
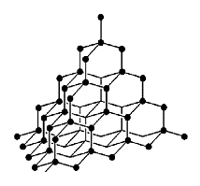
Рис. Кристаллическая решетка алмаза.
Свойства алмаза:
- бесцветное кристаллическое вещество;
- самое твердое вещество в природе;
- обладает сильным преломляющим эффектом;
- плохо проводит тепло и электричество.
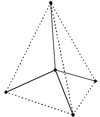
Рис. Тетраэдр алмаза.
Исключительная твердость алмаза объясняется строением его кристаллической решетки, которая имеет форму тетраэдра - в центре тетраэдра находится атом углерода, который связан равноценно прочными связями с четырьмя соседними атомами, образующими вершины тетраэдра (см. рисунок выше). Такая "конструкция" в свою очередь связана с соседними тетраэдрами.
Графит
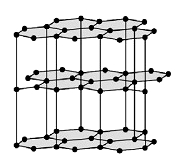
Рис. Кристаллическая решетка графита.
Свойства графита:
- мягкое кристаллическое вещество серого цвета слоистой структуры;
- обладает металлическим блеском;
- хорошо проводит электричество.
В графите атомы углерода образуют правильные шестиугольники, лежащие в одной плоскости, организованные в бесконечные слои.
В графите химические связи между соседними атомами углерода образованы за счет трех валентных электронов каждого атома (изображены синим цветом на рисунке ниже), при этом четвертый электрон (изображен красным цветом) каждого атома углерода, расположенный на p-орбитали, лежащей перпендикулярно плоскости слоя графита, не участвует в образовании ковалентных связей в плоскости слоя. Его "предназначение" заключается в другом - взаимодействуя со своим "собратом", лежащим в соседнем слое, он обеспечивает связь между слоями графита, а высокая подвижность p-электронов обусловливает хорошую электропроводность графита.
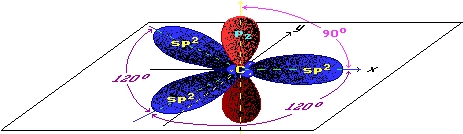
Рис. Распределение орбиталей атома углерода в графите.
Фуллерен
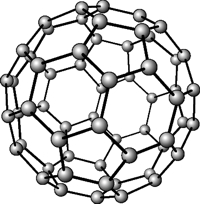
Рис. Кристаллическая решетка фуллерена.
Свойства фуллерена:
- молекула фуллерена представляет собой совокупность атомов углерода, замкнутых в полые сферы типа футбольного мяча;
- это мелкокристаллическое вещество желто-оранжевого цвета;
- температура плавления = 500-600°C;
- полупроводник;
- входит в состав минерала шунгита.
Карбин
Свойства карбина:
- инертное вещество черного цвета;
- состоит из полимерных линейных молекул, в которых атомы связаны чередующимися одинарными и тройными связями;
- полупроводник.
Химические свойства углерода
При нормальных условиях углерод является инертным веществом, но при нагревании может реагировать с разнообразными простыми и сложными веществами.
Выше уже было сказано, что на внешнем энергетическом уровне углерода находится 4 электрона (ни туда, ни сюда), поэтому углерод может, как отдавать электроны, так и принимать их, проявляя в одних соединениях восстановительные свойства, а в других - окислительные.
Углерод является восстановителем в реакциях с кислородом и другими элементами, имеющими более высокую электроотрицательность (см. таблицу электроотрицательности элементов):
- при нагревании на воздухе горит (при избытке кислорода с образованием углекислого газа; при его недостатке - оксида углерода(II)):
C + O2 = CO2;
2C + O2 = 2CO. - реагирует при высоких температурах с парами серы, легко взаимодействует с хлором, фтором:
C + 2S = CS2
C + 2Cl2 = CCl4
2F2 + C = CF4 - при нагревании восстанавливает из оксидов многие металлы и неметаллы:
C0 + Cu+2O = Cu0 + C+2O;
C0+C+4O2 = 2C+2O - при температуре 1000°C реагирует с водой (процесс газификации), с образованием водяного газа:
C + H2O = CO + H2;
Углерод проявляет окислительные свойства в реакциях с металлами и водородом:
- реагирует с металлами с образованием карбидов:
Ca + 2C = CaC2 - взаимодействуя с водородом, углерод образует метан:
C + 2H2 = CH4
Углерод получают термическим разложением его соединений или пиролизом метана (при высокой температуре):
CH4 = C + 2H2.
Применение углерода
Соединения углерода нашли самое широкое применение в народном хозяйстве, перечислить все их не представляется возможным, укажем только некоторые:
- графит применяется для изготовления грифелей карандашей, электродов, плавильных тиглей, как замедлитель нейтронов в ядерных реакторах, как смазочный материал;
- алмазы применяются в ювелирном деле, в качестве режущего инструмента, в буровом оборудовании, как абразивный материал;
- в качестве восстановителя углерод используют для получения некоторых металлов и неметаллов (железа, кремния);
- углерод составляет основную массу активированного угля, который нашел широчайшее применение, как в быту (например, в качестве адсорбента для очистки воздуха и растворов), так и в медицине (таблетки активированного угля) и в промышленности (в качестве носителя для каталитических добавок, катализатора полимеризации и проч.).
