Кислород (O)

- Обозначение - O (Oxygen);
- Латинское название - Oxigenium;
- Период - II;
- Группа - 16 (VIa);
- Атомная масса - 15,9994;
- Атомный номер - 8;
- Радиус атома = 60 пм;
- Ковалентный радиус = 73 пм;
- Распределение электронов - 1s22s22p4;
- t плавления = -218,4°C;
- t кипения = -182,96°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 3,44/3,50;
- Степень окисления: +2; +1; 1/2; 0; -1/3; -1/2; -1; -2;
- Плотность (н. у.) = 1,42897 г/см3;
- Молярный объем = 14,0 см3/моль.
Кислород ("рождающий кислоты") открыл в 1774 г. Дж. Пристли. Это самый распространенный химический элемент на Земле - массовая доля кислорода в земной коре составляет 47,2%. В атмосферном воздухе доля кислорода составляет 21%, что связано с деятельностью зеленых растений.
Кислород входит в состав многих, как неорганических, так и органических соединений. Кислород необходим для жизнедеятельности всех высокоорганизованных живых организмов: человека, зверей, птиц, рыб. Кислород составляет от 50 до 85% массы тканей животных и растений.
Известны три стабильных изотопа кислорода: 16O, 17O, 18O.
В свободном состоянии кислород существует в двух аллотропных модификациях: O2 - кислород; O3 - озон.
Кислород в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "8", относится к 16(VIa) группе (См. Атомы 16(VIa) группы).
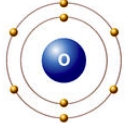
Рис. Строение атома кислорода.
Атом кислорода содержит 8 электронов: 2 электрона находятся на внутренней s-орбитали и еще 6 на внешнем энергетическом уровне - 2 (спаренных) на s-подуровне и 4 (два спаренных и два неспаренных) на p-подуровне (см. Электронная структура атомов).
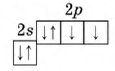
За счет двух неспаренных p-электронов внешнего уровня кислород образует две ковалентные связи, принимая два электрона и проявляя степень окисления -2 (H2O, CaO, H2SO4).
В соединениях с кислородной связью О-О атом кислорода проявляет степень окисления -1 (H2O2).
С более электроотрицательным фтором кислород отдает свои валентные электроны, проявляя степень окисления +2 (OF2).
O2
Двухатомная молекула кислорода образована двойной связью двух атомов кислорода. По этой причине молекулярный кислород при нормальных условиях является устойчивым соединением.
Энергия диссоциации молекулы кислорода примерно в 2 раза ниже, чем в молекуле азота (см. Кратность ковалентной связи), поэтому кислород по сравнению с азотом обладает более высокой реакционной способностью (но, гораздо меньшей по сравнению, например, с фтором).
Реакционная способность кислорода увеличивается по мере нагревания. Кислород реагирует со всеми элементами за исключением инертных газов. По причине своей высокой электроотрицательности (см. Что такое электроотрицательность) в химических соединениях (за исключением фтора) кислород выступает в роли окислителя со степенью -2 (только фтор окисляет кислород с образованием дифторида кислорода OF2).
Свойства газа кислорода:
- газ без цвета, запаха и вкуса;
- в жидком или твердом виде кислород имеет голубую окраску;
- умеренно растворим в воде: массовая доля кислорода при 20°C составляет 0,004%.
Химические свойства кислорода
Во всех реакциях кислород играет роль окислителя, соединяясь со всеми элементами (за исключением гелия, аргона и неона) непосредственным взаимодействием (кроме фтора, хлора, золота и платиновых металлов).
С металлами и неметаллами (простыми веществами) кислород образует оксиды:
2Cu + O2 = 2CuO 4Li + O2 = 2Li2O 2Ca + O2 = 2CaO S + O2 = SO2 C + O2 = CO2
При окислении щелочных металлов натрия и калия образуются пероксиды:
2Na + O2 = Na2O2
Практически все реакции с участием кислорода являются экзотермическими, но есть и исключения:
N2+O2 ↔ 2NO-Q
Многие вещества реагируют с кислородом с большим выделением тепла и света, такой процесс называется горением.
Реакции горения:
- горение аммиака на воздухе с образованием воды и азота:
4NH3+3O2 = 2N2+6H2O
- каталитическое окисление аммиака:
4NH3+5O2 = 2NO+6H2O
- горение сероводорода в избытке кислорода:
2H2S+3O2 = 2SO2+2H2O
- при недостатке кислорода сероводород медленно окисляется до свободной серы:
2H2S+O2 = 2S+2H2O
- горение органических веществ в кислороде с образованием воды и углекислого газа:
CH4+2O2 → CO2+2H2O C2H5OH+3O2 → 2CO2+3H2O
- при сгорании азотсодержащих органических веществ кроме углекислого газа и воды выделяется свободный азот:
4CH3NH5+9O2 → 4CO2+2N2+10H2O
Многие вещества (спирты, альдегиды, кислоты) получают реакцией контролируемого окисления органических веществ. Также многие природные процессы, например, дыхание или гниение, по своей сути являются окислительными реакциями органических веществ.
Еще более сильным окислителем, чем кислород, является озон, способный окислять йодид калия до свободного йона - эта реакция используется для качественного и количественного определения озона:O3+2KI+H2O = I2↓+2KOH+O2↑
Получение и применение кислорода
Кислород находит достаточно широкое применение в промышленности и медицине:
- в металлургии кислород используется при выплавке стали (чугуна);
- в химической промышленности кислород нужен для производства кислот (серной и азотной), метанола, ацетилена, альдегидов;
- в космической промышленности кислород используется в качестве окислителя ракетного топлива;
- в медицине кислород применяют в дыхательных аппаратах;
- в природе кислород играет исключительно важную роль, - в процессе окисления углеводов, жиров и белков происходит высвобождение энергии, необходимой для живых организмов.
Способы получения кислорода:
- промышленные способы:
- сжижением воздуха с последующим разделением жидкой смеси газов на компоненты;
- электролиз воды:
2H2O = 2H2 + O2.
- лабораторные способы (разложение солей при нагревании):
- перманганат калия:
2KMnO4 = K2MnO4 + MnO2 + O2; - бертолетова соль:
2KClO3 = 2KCl + 3O2.
- перманганат калия:
- термическое разложение нитратов щелочных металлов:
2NaNO3 = 2NaNO2+O2↑ - каталитическое разложение пероксида водорода (катализатор MnO2):
2H2O2 = 2H2O+O2↑; - взаимодействие пероксидов углекислого газа с пероксидами щелочных металлов:
2CO2+2Na2O2 = 2Na2CO3+O2↑.
