Сера (S)

- Обозначение - S (Sulphur);
- Период - III;
- Группа - 16 (VIa);
- Атомная масса - 32,066;
- Атомный номер - 16;
- Радиус атома = 127 пм;
- Ковалентный радиус = 102 пм;
- Распределение электронов - 1s22s22p63s23p4;
- t плавления = 112,8°C;
- t кипения = 444,674°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 2,58/2,44;
- Степень окисления: +6; +4; +2; +1; 0; -1; -2;
- Плотность (н. у.) = 2,070 г/см3;
- Молярный объем = 15,5 см3/моль.
Соединения серы:
- Сероводород H2S
- Сернистый газ
- Серный ангидрид
- Серная кислота H2SO4
- Уравнения окислительно-восстановительных реакций серы
Точное время открытия человеком серы неизвестно - данное вещество было известно человеку еще с доисторических времен. Природная сера является светло-желтым порошкообразным веществом, массовая доля серы в земной коре составляет 0,03%.
В природе сера встречается, как в виде самородков, так и в виде разнообразных соединений: сульфидов (FeS2; FeCuS2) и сульфатов (BaSO4), входящих в состав разнообразных минералов (пирит, медный колчедан, гипс, барит). Также сера в виде соединений присутствует в природных углеводородах: нефте, газе, угле.
Сера является биогенным элементом - в организме человека массовая доля серы составляет 0,16%, сера входит в состав белков, аминокислот, гормонов.
Сера в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "16", относится к 16(VIa) группе (см. Атомы 16(VIa) группы).
Атом серы содержит 16 электронов, при этом у серы, как и у атома кислорода, на внешнем энергетическом уровне находится 6 валентных электронов (см. Электронная структура атомов).
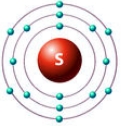
В отличие от кислорода, атом серы способен образовывать не только 2 (H2S) ковалентные связи, но и 4 (H2SO3) или 6 (H2SO4) (см. Ковалентная связь). Данное свойство объясняется наличием у атома серы свободного d-подуровня, на который могут переходить 1 или 2 электрона с s- или р-подуровня (см. Атомы 16(VIa) группы).
Сера, как простое вещество
Молекула S2 имеет строение, аналогичное O2.
В отличие от кислорода, сера может образовывать зигзазообразные цепи, но наиболее устойчивыми являются циклические молекулы серы, имеющие форму короны, в которую входят 8 атомов (S8) - α-сера. "Короны" с меньшим числом атомов менее устойчивы. Кроме этого, молекулы серы могут образовывать открытые цепи (S∞).
В ромбической модификации S8 - 8 атомов серы соединены между собой одинарными ковалентными связями - это твердые кристаллы желтого цвета, нерастворимые в воде, но хорошо растворяющиеся в органических растворителях, например, в сероуглероде.
Сера при высоких температурах может существовать в газообразном состоянии:
- S8
- S6 - 450°C
- S4 - 650°C
- S2 - 900°C
- S - 1500°C
Химические свойства серы
Сера является типичным активным неметаллом.
В воде сера практически не растворяется (даже не смачивается водой), а в органических растворителях сера растворяется хорошо.
При взаимодействии с другими веществами сера может выступать, как в роли окислителя, так и в роли восстановителя, в зависимости от окислительно-восстановительных свойств веществ, с которыми сера вступает в реакцию:
- окислителем сера является в реакциях с простыми веществами-восстановителями, имеющими меньшую электроотрицательность, чем сера - это водород, металлы, некоторые неметаллы:
S0+2e- → S-2
- восстановителем сера является в реакциях с кислородом, галогенами, кислотами-окислителями
S0-2e- → S+2 S0-4e- → S+4 S0-6e- → S+6
Реакции, в которых сера является окислителем:
- с металлами сера реагирует при нагревании с образованием сульфидов:
Fe0+S0 = Fe+2S-2 2Na0+S0 = Na2+1S-2
- с водородом:
S0+H20 = H2+1S-2;
- с фосфором:
3S0+2P0 = P2+3S3-2
- с углеродом:
C0+2S0 = C+4S2-2
Реакции, в которых сера является восстановителем:
- с кислородом:
S0 + O20 = S+4O2-2
- с хлором:
S0 + Cl20 = S+2Cl2-1
- с фтором:
S0 + 3F20 = S+6F6-1
Взаимодействие серы со сложными веществами:
- реагирует, как восстановитель с кислотами-окислителями при нагревании:
S0 + 2H2S+6O4 = 3S+4O2↑ + 2H2O S0 + 2HN+5O3 = H2S+6O4 + 2N+3O↑ S0 + 6HN+5O3 = H2S+6O4 + 6N+4O2↑ + 2H2O
- в реакциях диспропорционирования с растворами щелочей при нагревании сера выступает и окислителем, и восстановителем:
3S0 + 6NaOH = 2Na2S-2 + Na2S+4O3 + 3H2O
Аллотропные модификации серы
α-сера
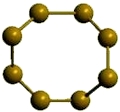
Рис. Ромбическая α-сера.
α-сера:
- кристаллическое вещество желтого цвета;
- устойчиво при комнатной температуре;
- состоит из циклических молекул S8.
- температура плавления = 112,8°C;
- плотность = 2,06 г/см3.
β-сера
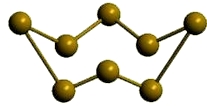
Рис. Моноклинная β-сера.
β-сера:
- темно-желтые кристаллы;
- устойчиво при температуре 95°C и выше;
- от альфа-серы отличается ориентацией кольцевых молекул в узлах кристаллической решетки;
- температура плавления = 119,3°C;
- плотность = 1,957 г/см3.
Пластическая сера
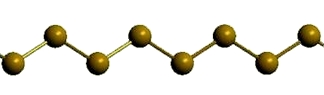
Рис. Пластическая сера.
Пластическая сера:
- резиноподобное вещество темно-коричневого цвета;
- образуется при резком охлаждении расплавленной серы;
- состоит из открытых цепных полимерных молекул (S∞);
- плотность = 2,046 г/см3.
Получение и применение серы
Способы получения серы:
- промышленным способом получения серы является очищение самородной серы от примесей расплавлением перегретым водяным паром;
- окислением сероводорода кислородом: 2H2S + O2 = 2S + 2H2O;
- восстановлением оксида серы (IV) углеродом: SO2 + C = S + CO2;
- разложением пирита (FeS2): FeS2 = S + FeS;
- разложением сероводорода: H2S = H2 + S.
Применение серы:
- как ингредиент для получения серной кислоты;
- в качестве инсектицида;
- для вулканизации каучука;
- в производстве пороха, спичек, лекарственных препаратов, красителей.
