Железо (Fe)

- Обозначение - Fe (Iron);
- Период - IV;
- Группа - 8 (VIII);
- Атомная масса - 55,845;
- Атомный номер - 26;
- Радиус атома = 126 пм;
- Ковалентный радиус = 117 пм;
- Распределение электронов - 1s22s22p63s23p63d64s2;
- t плавления = 1535°C;
- t кипения = 2750°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 1,83/1,64;
- Степень окисления: +8, +6, +4, +3, +2, +1, 0;
- Плотность (н. у.) = 7,874 г/см3;
- Молярный объем = 7,1 см3/моль.
Соединения железа:
Железо является самым распространенным металлом в земной коре (5,1% по массе) после алюминия.
На Земле железо в свободном состоянии встречается в незначительных количествах в виде самородков, а также в упавших метеоритах.
Промышленным способом железо добывают на железнорудных месторождениях, из железосодержащих минералов: магнитного, красного, бурого железняка.
Следует сказать, что железо входит в состав многих природных минералов, обуславливая их природную окраску. Окраска минералов зависит зависит от концентрации и соотношения ионов железа Fe2+/Fe3+, а также от атомов, окружающих эти ионы. Например, присутствие примесей ионов железа влияет на окраску многих драгоценных и полудрагоценных камней: топазов (от бледно-желтого до красного), сапфиров (от голубого до темно-синего), аквамаринов (от светло-голубого до зеленовато-голубого) и проч.
Железо содержится в тканях животных и растений, например, в организме взрослого человека присутствует около 5 г железа. Железо является жизненно важным элементом, оно входит в состав белка гемоглобина, участвуя в транспортировке кислорода от легких к тканям и клеткам. При недостатке железа в организме человека развивается малокровие (железодефицитная анемия).
Железо в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером "26", относится к переходным металлам (См. Атомы переходных элементов).
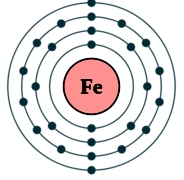
Рис. Строение атома железа.
Электронная конфигурация атома железа - 1s22s22p63s23p63d64s2 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 6 электронов 3d-подуровня (всего 8 электронов), поэтому в соединениях железо может принимать степени окисления +8, +6, +4, +3, +2, +1, (наиболее часто встречаются +3, +2). Железо обладает средней химической активностью.
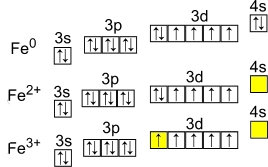
Рис. Степени окисления железа: +2, +3.
Физические свойства железа:
- металл серебристо-белого цвета;
- в чистом виде достаточно мягкий и пластичный;
- хобладает хорошей тепло- и электропроводимостью.
Железо существует в виде четырех модификаций (различаются строением кристаллической решетки): α-железо; β-железо; γ-железо; δ-железо.
Химические свойства железа
- реагирует с кислородом, в зависимости от температуры и концентрации кислорода могут образовываться различные продукты или смесь продуктов окисления железа (FeO, Fe2O3, Fe3O4):
3Fe + 2O2 = Fe3O4; - окисление железа при низких температурах:
4Fe + 3O2 = 2Fe2O3; - реагирует с водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2; - мелко раздробленное железо реагирует при нагревании с серой и хлором (сульфид и хлорид железа):
Fe + S = FeS; 2Fe + 3Cl2 = 2FeCl3; - при высоких температурах реагирует с кремнием, углеродом, фосфором:
3Fe + C = Fe3C; - с другими металлами и с неметаллами железо может образовывать сплавы;
- железо вытесняет менее активные металлы из их солей:
Fe + CuCl2 = FeCl2 + Cu; - с разбавленными кислотами железо выступает в роли восстановителя, образуя соли:
Fe + 2HCl = FeCl2 + H2; - с разбавленной азотной кислотой железо образует различные продукты восстановления кислоты, в зависимости от ее концентрации (N2, N2O, NO2).
Получение и применение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун - это сплав железа с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%).
Чистое железо получают:
- в кислородных конверторах из чугуна;
- восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
- электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Доменная печь является очень сложным техническим сооружением высотой в несколько десятков метров. Она выкладывается из огнеупорного кирпича и защищается внешним стальным кожухом. По состоянию на 2013 год самая крупная доменная печь была построена в Южной Корее сталелитейной компанией POSCO на металлургическом заводе в городе Кванъян (объем печи после модернизации составил 6000 кубометров при ежегодной производительности 5 700 000 тонн).

Рис. Доменная печь.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.
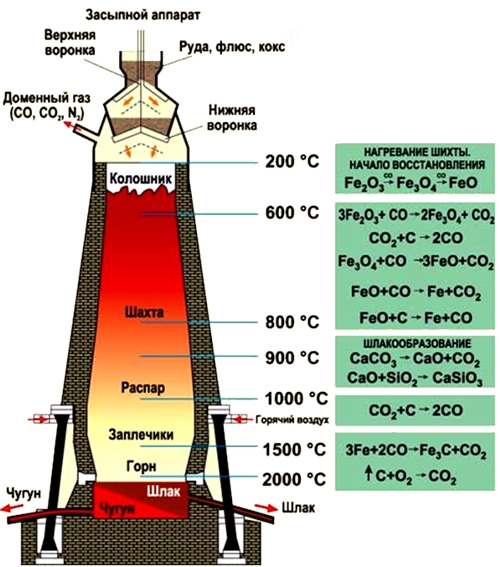
Рис. Процесс выплавки чугуна в доменной печи.
- обогащенные руды (магнитный, красный, бурый железняк) и кокс засыпаются через колошник, расположенный в самом верху доменной печи;
- процессы восстановления железа из руды под действием оксида углерода (II) протекают в средней части доменной печи (шахте) при температуре 450-1100°C (оксиды железа восстанавливаются до металла):
- 450-500°C - 3Fe2O3 + CO = 2Fe3O4 + CO2;
- 600°C - Fe3O4 + CO = 3FeO + CO2;
- 800°C - FeO + CO = Fe + CO2;
- часть двухвалентного оксида железа восстанавливается коксом: FeO + C = Fe + CO.
- параллельно идет процесс восстановления оксидов кремния и марганца (входят в железную руду в виде примесей), кремний и марганец входят в состав выплавляющегося чугуна:
- SiO2 + 2C = Si + 2CO;
- Mn2O3 + 3C = 2Mn + 3CO.
- при термическом разложении известняка (вносится в доменную печь) образуется оксид кальция, который реагирует с оксидами кремния и алюминия, содержащихся в руде:
- CaCO3 = CaO + CO2;
- CaO + SiO2 = CaSiO3;
- CaO + Al2O3 = Ca(AlO2)2.
- при 1100°C процесс восстановления железа прекращается;
- ниже шахты располагается распар, самая широкая часть доменной печи, ниже которой следует заплечник, в котором выгорает кокс и образуются жидкие продукты плавки - чугун и шлаки, накапливающиеся в самом низу печи - горне;
- в верхней части горна при температуре 1500°C в струе вдуваемого воздуха происходит интенсивное сгорание кокса: C + O2 = CO2;
- проходя через раскаленный кокс, оксид углерода (IV) превращается в оксид углерода (II), являющийся восстановителем железа (см. выше): CO2 + C = 2CO;
- шлаки, образованные силикатами и алюмосиликатами кальция, располагаются выше чугуна, защищая его от действия кислорода;
- через специальные отверстия, расположенные на разных уровнях горна, чугун и шлаки выпускаются наружу;
- бОльшая часть чугуна идет на дальнейшую переработку - выплавку стали.
Сталь выплавляют из чугуна и металлолома конверторным способом (мартеновский уже устарел, хотя еще и применяется) или электроплавкой (в электропечах, индукционных печах). Суть процесса (передела чугуна) заключается в понижении концентрации углерода и других примесей путем окисления кислородом.
Как уже было сказано выше, концентрация углерода в стали не превышает 2%. Благодаря этому, сталь в отличие от чугуна достаточно легко поддается ковке и прокатке, что позволяет изготавливать из нее разнообразные изделия, обладающие высокой твердостью и прочностью.
Твердость стали зависит от содержания углерода (чем больше углерода, тем тверже сталь) в конкретной марке стали и условий термообработки. При отпуске (медленном охлаждении) сталь становится мягкой; при закалке (быстром охлаждении) сталь получается очень твердой.
Для придания стали нужных специфических свойств в нее добавляют лигирующие добавки: хром, никель, кремний, молибден, ванадий, марганец и проч.
Чугун и сталь являются важнейшими конструкционными материалами в подавляющем большинстве отраслей народного хозяйства.
Биологическая роль железа:
- в организме взрослого человека содержится около 5 г железа;
- железо играет важную роль в работе кроветворных органов;
- железо входит в состав многих сложных белковых комплексов (гемоглобина, миоглобина, различных ферментов).
